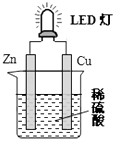
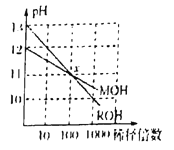
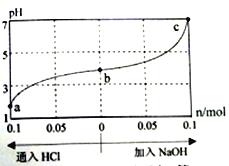
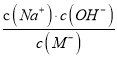题目内容
【题目】在反应 3 Cl2 + 6KOH = 5KCl + KClO3 + 3H2O 中,被氧化的氯原子与被还原的氯原子的质量之比是
A. 1:6 B. 6:1 C. 5:1 D. 1:5
【答案】D
【解析】
由反应3Cl2+6KOH=KClO3+5KCl+3H2O可知,反应中Cl2分子中部分Cl元素由0升高为+5价,部分由0降低为-1价。
该反应为歧化反应。从方程式可知参加反应的3个Cl2中,有1个Cl由0价升高到+5价,这1个Cl被氧化,另外5个Cl由0价降低到-1价,这5个Cl被还原,因此被氧化的氯原子与被还原的氯原子的原子个数比为1∶5,即它们的质量比为1∶5,故选D。

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目