题目内容
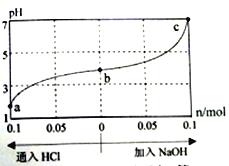
【题目】25℃时,由酸(HM) 及其盐(NaM) 组成的混合溶液,起始浓度均为1mol/L。向该溶液中通入HCl气体或加入NaOH固体时,溶液pH的变化曲线如图所示。下列说法不正确的是
A. HM是弱酸 B. 加入NaOH过程中, 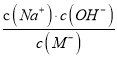 的值减小
的值减小
C. c点时,溶液中c(Na+)=c(M-) D. a、b、c对应溶液中,水的电离程度: a<b<c
【答案】B
【解析】A项,25℃时,由酸(HM)及其盐(NaM)组成的混合溶液,起始浓度均为1mol/L,由图可得,未加NaOH固体和HCl气体之前,pH介于3~5之间,所以HM不完全电离,应为弱酸,故A正确;B项, 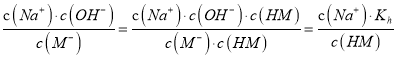 ,温度不变,则Kh不变,加入NaOH过程中,c(Na+)增大,c(HM)减小,所以
,温度不变,则Kh不变,加入NaOH过程中,c(Na+)增大,c(HM)减小,所以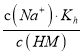 的值增大,即
的值增大,即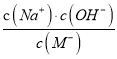 的值增大,故B错误;C项,25℃时,c点pH=7,则c(H+)=c(OH-),又根据电荷守恒得:c(Na+)+c(H+)=c(M-)+c(OH-),所以c(Na+)=c(M-),故C正确;D项,a、b溶液呈酸性,抑制水的电离,c呈中性,pH越小,酸性越强,水的电离程度越小,则a、b、c三点所表示的溶液中水的电离程度依次增大,即:a<b<c,故D正确。
的值增大,故B错误;C项,25℃时,c点pH=7,则c(H+)=c(OH-),又根据电荷守恒得:c(Na+)+c(H+)=c(M-)+c(OH-),所以c(Na+)=c(M-),故C正确;D项,a、b溶液呈酸性,抑制水的电离,c呈中性,pH越小,酸性越强,水的电离程度越小,则a、b、c三点所表示的溶液中水的电离程度依次增大,即:a<b<c,故D正确。

练习册系列答案
相关题目