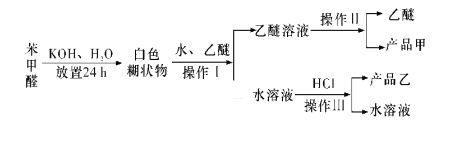
题目内容
【题目】500 mL AgNO3和Ca(NO3)2的混合溶液中c(NO![]() )=0.6 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24 L气体(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
)=0.6 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24 L气体(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
A.原混合溶液中c(Ca2+)为0.1 mol·L-1B.上述电解过程中共转移0.2 mol电子
C.电解得到的Ag的物质的量为0.1 molD.电解后溶液中c(H+)为0.2 mol·L-1
【答案】A
【解析】
电解AgNO3和Ca(NO3)2的混合溶液时,阳极上OH- 放电生成O2,阴极上先Ag+ 放电生成Ag,当Ag+ 完全析出时,H+ 放电生成H2,在标准状况下,当通电一段时间后,两极均收集到2.24 L气体,其物质的量为:![]() ,每生成1mol O2,转移
,每生成1mol O2,转移
4mol e-,每生成1mol H2,转移2mol e-,每生成1mol Ag,转移1mol e-。
A. 根据转移电子守恒,![]() ,
,![]() ,根据电荷守恒,
,根据电荷守恒,![]() ,A正确;
,A正确;
B. 转移电子的物质的量为:![]() ,B错误;
,B错误;
C. 根据转移电子守恒,![]() ,C错误;
,C错误;
D. 当电解AgNO3溶液时,产生H+,当电解Ca(NO3)2溶液时,实际上是电解水,电解后溶液中H+的物质的量为O2的4倍,![]() ,
,![]() ,D错误。
,D错误。

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目