题目内容
【题目】硅在地壳中的含量较高,硅及其化合物的开发由来已久,在现代生活中有广泛应用.回答下列问题:
(1)陶瓷、水泥和玻璃是常用的传统的无机非金属材料,其中生产普通玻璃的主要原料有____________________。
(2)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料.工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如图:
ⅰ锌还原四氯化硅是一种有着良好应用前景的制备硅的方法,该制备过程示意如下:
![]()
① 过程Ⅰ发生反应的化学方程式为______________________(SiO2+3C![]() SiC+2CO↑为副反应)若产品中单质硅与碳化硅的物质的量之比为1:1,则参加反应的C和SiO2的质量之比为________________。
SiC+2CO↑为副反应)若产品中单质硅与碳化硅的物质的量之比为1:1,则参加反应的C和SiO2的质量之比为________________。
②整个制备过程必须严格控制无水。SiCl4遇水剧烈水解生成两种酸,反应的化学方程式是_________________________。
ⅱ 工业上也可以通过如下图所示的流程制取纯硅:
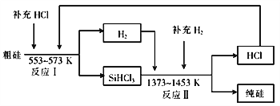
①有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和_________;SiHCl3极易水解,其完全水解的化学方程式为___________________________。
物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | ﹣30.4 | ﹣84.9 | ﹣111.9 |
② 假设每一轮次制备1mol纯硅,且生产过程中硅元素没有损失,反应I中HCl的利用率为90%,反应II中H2的利用率为93.75%,则在第二轮次的生产中,补充投入HCl 和H2的物质的量之比是___________________。
【答案】 纯碱、石英、石灰石 SiO2+2C![]() Si+2CO↑ 1:2 SiCl4+ 3H2O = H2SiO3↓+ 4HCl 蒸馏 SiHCl3+3H2O═H2SiO3↓+H2↑+3HCl↑ 5:1
Si+2CO↑ 1:2 SiCl4+ 3H2O = H2SiO3↓+ 4HCl 蒸馏 SiHCl3+3H2O═H2SiO3↓+H2↑+3HCl↑ 5:1
【解析】(1)工业上生产普通玻璃的主要原料是纯碱、石英、石灰石,故答案为:纯碱、石英、石灰石;
(2)i. ① 过程Ⅰ中二氧化硅与C在高温下反应生成硅和一氧化碳,反应的化学方程式为SiO2+2C ![]() Si+2CO↑,反应中的副反应为SiO2+3C
Si+2CO↑,反应中的副反应为SiO2+3C![]() SiC+2CO↑,若产品中单质硅与碳化硅的物质的量之比为1:1,根据方程式,生成1mol硅和碳化硅,参加反应的C和SiO2的物质的量分别为5mol和2mol,质量之比为5mol×12g/mol:2mol×60g/mol=1:2,故答案为:SiO2+2C
SiC+2CO↑,若产品中单质硅与碳化硅的物质的量之比为1:1,根据方程式,生成1mol硅和碳化硅,参加反应的C和SiO2的物质的量分别为5mol和2mol,质量之比为5mol×12g/mol:2mol×60g/mol=1:2,故答案为:SiO2+2C ![]() Si+2CO↑;1:2;
Si+2CO↑;1:2;
②SiCl4遇水剧烈水解生成两种酸,反应的化学方程式为SiCl4 + 3H2O = H2SiO3↓ + 4HCl,故答案为:SiCl4 + 3H2O = H2SiO3↓ + 4HCl;
ⅱ. ①利用沸点的不同提纯SiHCl3属于蒸馏,SiHCl3(沸点31.8℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.9℃),由于沸点差别较大,可以通过精馏(或蒸馏)除去杂质;SiHCl3水解反应生成硅酸、氢气和氯化氢,反应的方程式为:SiHCl3+3H2O═H2SiO3+ H2↑+ 3HCl↑;故答案为:蒸馏;SiHCl3+3H2O═H2SiO3↓+H2↑+3HCl↑;
② 根据①中方程式SiHCl3+3H2O═H2SiO3↓+H2↑+3HCl↑可知,反应生产1mol纯硅需补充HCl: ![]() -3,需补充H2:
-3,需补充H2: ![]() -1,补充HCl与H2的物质的量之比为(
-1,补充HCl与H2的物质的量之比为(![]() -3):(
-3):(![]() -1)≈5:1,故答案为:5:1。
-1)≈5:1,故答案为:5:1。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案

