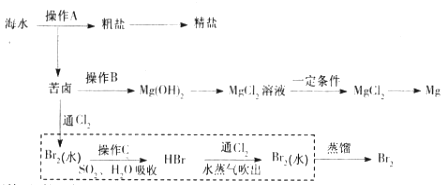
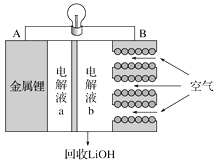
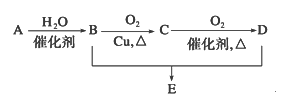
题目内容
【题目】苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是:C8H10(g)C8H8(g)+H2(g)△H=120kJ·mol-1某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内气体物质的量,得到数据如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(C8H10)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
(1)当反应进行到20min时,该段时间内H2的平均反应速率是_____________。
(2)该温度下,该反应的化学平衡常数是_______________________。
(3)若保持其他条件不变,用0.40 molH2(g)和0.40molC8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是__________。此时,该合成反应是否达到了平衡状态?_______(填“是”或“否”)。
(4)工业上以高温水蒸气作为反应体系的稀释剂(不参与反应),C8H10(g)的平衡转化率与水蒸气的用量、体系的温度、压强的关系如图Ⅰ、图Ⅱ所示。

①由图Ⅰ可知,T1________T2(填“大于”、“小于”或“等于”)。
②由图Ⅱ可知,当其他条件不变时,水蒸气的用量越大,C8H10的平衡转化率将________(填“越大”、“越小”或“不变”),原因是______________________________________。
【答案】4×10-3mol.L-1.min-10.1062.5%否大于越大随着水蒸气的加入,扩大了容器体积,相当于对反应体系减小压强(或使Q<K),从而使平衡右移,转化率增大。
【解析】I.(1)将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,20min后,剩余0.24mol,减少了0.16mol,
C8H10(g)![]() C8H8(g)+H2(g)
C8H8(g)+H2(g)
起始(mol) 0.40 0 0
变化(mol) 0.16 0.16 0.16
20min(mol) 0.24 0.16 0.16
v(H2)=![]() =0.004mol/(Lmin),故答案为:0.004mol/(Lmin);
=0.004mol/(Lmin),故答案为:0.004mol/(Lmin);
(2) C8H10(g)![]() C8H8(g)+H2(g)
C8H8(g)+H2(g)
起始(mol/L) 0.20 0 0
变化(mol/L) 0.10 0.10 0.10
30min(mol/L) 0.10 0.10 0.10
化学平衡常数K=![]() =
=![]() =0.10;故答案为:0.10;
=0.10;故答案为:0.10;
(3)根据C8H10(g)![]() C8H8(g)+H2(g),△H=120kJ·mol-1,可知 C8H8(g)+H2(g)
C8H8(g)+H2(g),△H=120kJ·mol-1,可知 C8H8(g)+H2(g)![]() C8H10(g) △H=-120kJmol-1,有30kJ热量放出时,消耗的H2量为0.25mol,所以氢气转化率=
C8H10(g) △H=-120kJmol-1,有30kJ热量放出时,消耗的H2量为0.25mol,所以氢气转化率=![]() ×100%=
×100%=![]() ×100%=62.5%;根据(2)知,C8H8(g)+H2(g)
×100%=62.5%;根据(2)知,C8H8(g)+H2(g)![]() C8H10(g)的平衡常数为
C8H10(g)的平衡常数为![]() =10,
=10,
C8H8(g)+H2(g)![]() C8H10(g)
C8H10(g)
起始(mol/L) 0.2 0.2 0
变化(mol/L) 0.125 0.125 0.125
某时刻(mol/L) 0.75 0.75 0.125
![]() =
=![]() =
=![]() ≠10,反应不是平衡状态;故答案为:62.5%;否;
≠10,反应不是平衡状态;故答案为:62.5%;否;
Ⅱ.(4)C8H10(g)![]() C8H8(g)+H2(g)△H=125kJmol-1,温度升高,平衡正向移动,C8H10的转化率增大,由图I可知,压强相同时,T1时C8H10的转化率大于T2时C8H10的转化率,故T1大于T2;故答案为:大于;
C8H8(g)+H2(g)△H=125kJmol-1,温度升高,平衡正向移动,C8H10的转化率增大,由图I可知,压强相同时,T1时C8H10的转化率大于T2时C8H10的转化率,故T1大于T2;故答案为:大于;
(5)其他条件不变,水蒸气的用量越大,容器的体积越大,相当于减小了原体系的压强,平衡正向移动,转化率增大;故答案为:越大;水蒸气的用量越大,容器的体积越大,相当于减小了原体系的压强,平衡正向移动,转化率增大。

【题目】氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用下图表示。

(1)海洋中的氮循环起始于氮的固定,其中属于固氮作用的一步是_________(填图中数字序号)。
(2)下列关于海洋氮循环的说法正确的是__________(填字母序号)。
a. 海洋中存在游离态的氮
b. 海洋中的氮循环起始于氮的氧化
c. 海洋中的反硝化作用一定有氧气的参与
d. 向海洋排放含NO3-的废水会影响海洋中NH4+的含量
(3)有氧时,在硝化细菌作用下,NH4+可实现过程④的转化,将过程④的离子方程式补充完整:_____NH4+ + 5 O2==2 NO2- + ___ H+ + ______+ _______
(4)有人研究了温度对海洋硝化细菌去除氨氮效果的影响,下表为对10 L人工海水样本的监测数据:
温度/℃ | 样本氨氮含量/mg[ | 处理24 h[] | 处理48 h |
氨氮含量/mg | 氨氮含量/mg | ||
20 | 1008 | 838 | 788 |
25 | 1008 | 757 | 468 |
30 | 1008 | 798 | 600 |
40 | 1008 | 977 | 910 |
硝化细菌去除氨氮的最佳反应温度是______,在最佳反应温度时,48 h内去除氨氮反应的平均速率是______________mg·L-1·h-1。
(5)为了避免含氮废水对海洋氮循环系统的影响,需经处理后排放。图是电解产物氧化工业废水中氨氮(NH4+)的示意图。

①阳极的电极反应式:____________________;
②写出电解产物氧化去除氨氮的离子方程式:____________;
③若生成H2和N2的物质的量之比为3:1,则处理后废水的c(H+)将________(填“增大”、“不变”或“减小”)。