题目内容
【题目】向20 mL1 mol·L-1 AlCl3溶液中滴入1 mol·L-1NaOH溶液时,沉淀物质的量(mol)与所滴加NaOH溶液体积(mL)关系如图所示:

(1)图中A点表示的意义是__________________________,B、C点数值比为__________。
(2)图中OA段发生反应的化学方程式可表示为:________________________________,AC段发生反应的化学方程式可表示为:_________________________________________,往C点对应溶液中通入过量CO2发生反应的离子方程式为:_________________________。
(3)A点对应的沉淀的物质的量为_________mol。
【答案】 生成最大量的氢氧化铝沉淀 3:4 AlCl3+ 3NaOH= Al(OH)3↓+3NaCl Al(OH)3+ NaOH = NaAlO2 + 2H2O AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓ 0.02
【解析】(1)由图象可知,O~A发生反应:AlCl3+3NaOH =Al(OH)3↓+3NaCl,A点时Al3+完全沉淀,因此图中A点表示的意义是生成最大量的氢氧化铝沉淀;由图象可知A~C发生反应:Al(OH)3+NaOH=NaAlO2+2H2O,则B点时氢氧化铝刚好完全溶解,根据方程式可知生成氢氧化铝消耗的氢氧化钠溶液体积是溶解氢氧化铝消耗的氢氧化钠溶液体积的3倍,则B、C点数值比为3:4;(2)根据以上分析可知图中OA段发生反应的化学方程式可表示为AlCl3+3NaOH =Al(OH)3↓+3NaCl,AC段发生反应的化学方程式可表示为Al(OH)3+NaOH=NaAlO2+2H2O。C点溶液中含有偏铝酸钠,则往C点对应溶液中通入过量CO2发生反应的离子方程式为AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓;(3)氯化铝的物质的量是0.02L×1mol/L=0.02mol,根据铝原子守恒可知生成氢氧化铝是0.02mol,即A点对应的沉淀的物质的量为0.02mol。

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案【题目】从海水中可提取各种化工产品,下图是工业上对海水的一种综合利用的流程图:
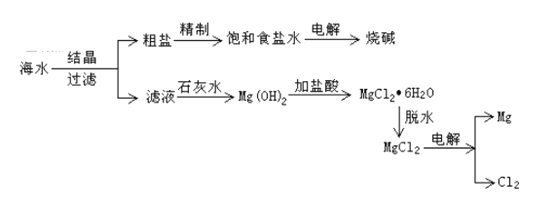
(1)过滤时所需要玻璃仪器为烧杯、漏斗和_________,补填的玻璃仪器在过滤时,起到了______________的作用。
(2)下图为电解食盐水的装置,石墨电极上产生的气体为_________;在铁棒周围的溶液里滴加酚酞溶液,溶液变________色。
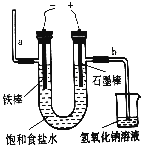
(3)写出电解饱和食盐水的化学方程式:____________________________。
(4)下表是某“加碘食盐”包装袋上的部分文字说明.
配料 | 氯化钠(NaCl)、碘酸钾(KIO3) |
含碘量 | 20~40 mg·kg-1 |
保质期 | 18个月 |
食用方法 | 勿长时间炖炒 |
贮藏指南 | 避热、避光、密封、防潮 |
①经测定,该“加碘食盐”中KIO3的含量为42.8 mg·kg-1。计算每千克“加碘食盐”中KIO3的物质的量为__mol,该“加碘食盐”的含碘量为__mg·kg-1。
②将5.0 g该“加碘食盐”溶于水中配成100 mL溶液,该溶液中IO3-离子物质的量浓度为___________mol·L-1。
