题目内容
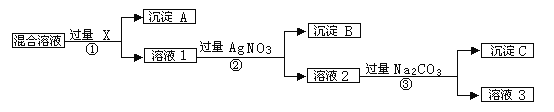
【题目】为验证Cl2、Br2的氧化性强弱,设计了如下实验:(可供选择的试剂有:氯水、溴水、NaCl溶液、NaBr溶液、酒精、四氯化碳)实验步骤如图,填写图中的空白. 
(1)2mL 试剂;加入少量试剂;再加入 试剂; 现象: .
(2)可以证明Cl2的氧化性(填“强于”或“弱于”)Br2的氧化性;氯元素的非金属性(填“强于”或“弱于”)溴元素的非金属性.
(3)此反应的离子方程式为: .
(4)某溶液中Cl﹣、Br﹣、I﹣的物质的量之比为4:1:4,要使溶液中的Cl﹣、Br﹣、I﹣的物质的量之比变为7:1:1,则通入Cl2的物质的量与原溶液中I﹣的物质的量之比为 .
【答案】
(1)NaBr溶液;氯水;四氯化碳;溶液分层,下层橙红色,上层无色
(2)强于;强于
(3)Cl2+2Br﹣=Br2+2Cl﹣
(4)3:8
【解析】解:(1)要想比较氯气和溴单质的氧化性大小,做如下实验: 少量溴化钠反应→加适量氯水(振荡,溶液由黄绿色变成橙色)→加入四氯化碳(振荡)→现象(溶液分层,下层橙红色,上层无色)→说明氯气和溴离子反应,能证明氯气的氧化性大于溴,溴单质在四氯化碳中的溶解度大于在水中的溶解度,水和四氯化碳是互不相溶的,所以会看到:溶液分层,下层橙红色,上层无色,
所以答案是:NaBr溶液;氯水;四氯化碳;溶液分层,下层橙红色,上层无色;(2)通过以上实验知,氯气能将溴单质置换出来,氯气的氧化性大于溴,离子方程式为:Cl2+2Br﹣=Br2+2Cl﹣ , 单质氧化性越强对应非金属性越强,则氯元素的非金属性强于溴元素的非金属性,所以答案是:强于;(3)氯气能将溴单质置换出来,氯气的氧化性大于溴,离子方程式为:Cl2+2Br﹣=Br2+2Cl﹣ , 所以答案是:Cl2+2Br﹣=Br2+2Cl﹣;(4)还原性:I﹣>Br﹣>Cl﹣ , 通入一定量的Cl2 , Cl﹣、Br﹣、I﹣三者物质的量之比由4:1:4变为7:1:1,说明溶液还有剩余的I﹣ , 则溶液中的Br﹣不反应,
设开始Cl﹣、Br﹣、I﹣三者物质的量分别是4mol、1mol、4mol,则反应后分别为7mol、1mol、1mol,则Cl﹣增加7mol﹣4mol=3mol,由方程式2I﹣+Cl2=I2+2Cl﹣可知参加反应的Cl2为:3mol× ![]() =1.5mol,所以通入Cl2的物质的量是原溶液中I﹣物质的量之比为:
=1.5mol,所以通入Cl2的物质的量是原溶液中I﹣物质的量之比为: ![]() =
= ![]() ,所以答案是:
,所以答案是: ![]() ,
,

 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案【题目】从海水中可提取各种化工产品,下图是工业上对海水的一种综合利用的流程图:

(1)过滤时所需要玻璃仪器为烧杯、漏斗和_________,补填的玻璃仪器在过滤时,起到了______________的作用。
(2)下图为电解食盐水的装置,石墨电极上产生的气体为_________;在铁棒周围的溶液里滴加酚酞溶液,溶液变________色。

(3)写出电解饱和食盐水的化学方程式:____________________________。
(4)下表是某“加碘食盐”包装袋上的部分文字说明.
配料 | 氯化钠(NaCl)、碘酸钾(KIO3) |
含碘量 | 20~40 mg·kg-1 |
保质期 | 18个月 |
食用方法 | 勿长时间炖炒 |
贮藏指南 | 避热、避光、密封、防潮 |
①经测定,该“加碘食盐”中KIO3的含量为42.8 mg·kg-1。计算每千克“加碘食盐”中KIO3的物质的量为__mol,该“加碘食盐”的含碘量为__mg·kg-1。
②将5.0 g该“加碘食盐”溶于水中配成100 mL溶液,该溶液中IO3-离子物质的量浓度为___________mol·L-1。