��Ŀ����
���ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���á���ش���������

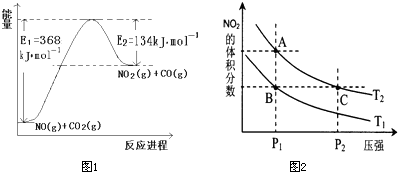
��1����ͼ��1mol NO2��1mol CO��Ӧ����CO2��NO�����������仯ʾ��ͼ����д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ________________________��
��2���ڶ�������ܱ������У��������»�ѧ��Ӧ��N2(g)+3H2(g) 2NH3(g)���仯ѧƽ�ⳣ��K��t�Ĺ�ϵ���±�
2NH3(g)���仯ѧƽ�ⳣ��K��t�Ĺ�ϵ���±�
��2���ڶ�������ܱ������У��������»�ѧ��Ӧ��N2(g)+3H2(g)
 2NH3(g)���仯ѧƽ�ⳣ��K��t�Ĺ�ϵ���±�
2NH3(g)���仯ѧƽ�ⳣ��K��t�Ĺ�ϵ���±�
������������⣺
��д���÷�Ӧ��ƽ�ⳣ������ʽ��K=_________________ �ԱȽ�K1��K2�Ĵ�С��K1________K2����д��>����=����<����
�����и�������Ϊ�жϸ÷�Ӧ�ﵽ��ѧƽ��״̬�����ݵ���_______________���������ĸ����
A��������N2��H2��NH3��Ũ��֮��Ϊ1��3��2
B��3v(N2)(��) = v(H2)(��)
C��������ѹǿ���ֲ���
D�����������ܶȱ��ֲ���
����������Ӧ�ﵽƽ��ʱ��N2��H2��NH3��Ũ��֮��Ϊ1��3��2�����������а����ʵ���֮��1��3��2ͨ��N2��H2��NH3����ԭƽ����ȣ�N2�����ʵ���Ũ��_____________����������С����ͬ����NH3���������____________________��
��3�������£�N2H6Cl2����һ����Ҫ�Ļ���ԭ�ϣ��������ӻ����������ˮ����Һ�����ԣ�ˮ��ԭ����NH4Cl���ơ�д�������µ�һ��ˮ�ⷴӦ�����ӷ���ʽ_____________________��
��д���÷�Ӧ��ƽ�ⳣ������ʽ��K=_________________ �ԱȽ�K1��K2�Ĵ�С��K1________K2����д��>����=����<����
�����и�������Ϊ�жϸ÷�Ӧ�ﵽ��ѧƽ��״̬�����ݵ���_______________���������ĸ����
A��������N2��H2��NH3��Ũ��֮��Ϊ1��3��2
B��3v(N2)(��) = v(H2)(��)
C��������ѹǿ���ֲ���
D�����������ܶȱ��ֲ���
����������Ӧ�ﵽƽ��ʱ��N2��H2��NH3��Ũ��֮��Ϊ1��3��2�����������а����ʵ���֮��1��3��2ͨ��N2��H2��NH3����ԭƽ����ȣ�N2�����ʵ���Ũ��_____________����������С����ͬ����NH3���������____________________��
��3�������£�N2H6Cl2����һ����Ҫ�Ļ���ԭ�ϣ��������ӻ����������ˮ����Һ�����ԣ�ˮ��ԭ����NH4Cl���ơ�д�������µ�һ��ˮ�ⷴӦ�����ӷ���ʽ_____________________��
��1��NO2(g)+CO(g)==CO2(g)+NO(g) ��H=-234kJ��mol-1
��2����K=C2(NH3)/C(N2)��C3(H2)��������BC������������
��3����N2H62++H2O [N2H5��H2O]++H+
[N2H5��H2O]++H+
��2����K=C2(NH3)/C(N2)��C3(H2)��������BC������������
��3����N2H62++H2O
 [N2H5��H2O]++H+
[N2H5��H2O]++H+
��ϰ��ϵ�д�
�����Ŀ
 ���ǵ����Ϻ����ḻ��Ԫ�أ������仯������о���������������������Ҫ���壮
���ǵ����Ϻ����ḻ��Ԫ�أ������仯������о���������������������Ҫ���壮