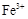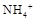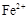题目内容
某溶液中可能含有下列6种离子中的某几种:Cl-、SO42-、CO32-、NH4+、Na+、K+。为确认溶液组成进行如下实验:(1)200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶。(2)向(1)的滤液中加入足量的NaOH溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出)。由此可以得出关于原溶液组成的正确结论是
| A.一定存在SO42-、CO32-、NH4+,可能存在Cl-、Na+、K+ |
| B.一定存在SO42-、CO32-、NH4+、Cl-,一定不存在Na+、K+ |
| C.c(CO32-)=0.01mol·L-1,c(NH4+)>c(SO42-) |
| D.如果上述6种离子都存在,则c(Cl-)>c(SO42-) |
D
根据(1)可知硫酸钡沉淀是2.33g,物质的量是0.01mol,即SO42-的物质的量是0.01mol。溶解的沉淀质量是4.30g-2.33g=1.97g,即碳酸钡是1.97g,物质的量是0.01mol,即CO32-的物质的量是0.01mol。根据(2)可知生成的氨气是0.05mol,则NH4+的物质的量是0.05mol。根据电荷守恒可知,溶液中一定还含有氯离子,而钠离子和钾离子无法判断。因为溶液体积无法确定,所以C不正确,因此答案选D。

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
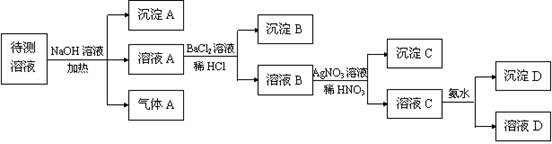
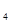 )2
)2  3)另取部分溶液,加入少量金属铜粉,铜粉溶解,且有气泡冒出,则溶液中肯定存在的阴离子是 。
3)另取部分溶液,加入少量金属铜粉,铜粉溶解,且有气泡冒出,则溶液中肯定存在的阴离子是 。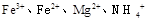 的溶液中,加入足量的
的溶液中,加入足量的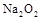 固体,充分反应后再加入过量的稀盐酸,溶液中离子数目不变化的是
固体,充分反应后再加入过量的稀盐酸,溶液中离子数目不变化的是