题目内容
(10分)在某澄清、透明的浅黄色溶液中,可能含有K+、NH4+、Fe3+、Ba2+、Al3+、SO42-、HCO3-、Cl-离子。进行下述实验(所加试剂均过量)。
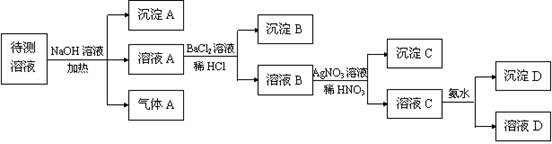
(1)气体A的化学式是 ,沉淀A的化学式是 ;
(2)待测液中一定存在 ;一定不存在 _______ ;
(3)写出溶液C与过量氨水反应的离子方程式 。
(4)三硅酸镁被用来治疗胃酸过多的胃溃疡,是因为该物质不溶于水,服用后能中和胃酸,作用持久。把三硅酸镁(Mg2Si3O8·nH2O)改写成氧化物的形式为 ,
它中和胃酸(HCl)的离子方程式是: 。

(1)气体A的化学式是 ,沉淀A的化学式是 ;
(2)待测液中一定存在 ;一定不存在 _______ ;
(3)写出溶液C与过量氨水反应的离子方程式 。
(4)三硅酸镁被用来治疗胃酸过多的胃溃疡,是因为该物质不溶于水,服用后能中和胃酸,作用持久。把三硅酸镁(Mg2Si3O8·nH2O)改写成氧化物的形式为 ,
它中和胃酸(HCl)的离子方程式是: 。
(1)NH3;Fe(OH)3 (2)NH4+ Fe3+ Al3+ SO42-; Ba2+ HCO3-
(3)Al3++3NH3·H2O=Al(OH)3↓+3NH4+ (4)2MgO·3SiO2·nH2O;(以上各1分)
2MgO·3SiO2·nH2O+4H+=2Mg2++3H2SiO3+(n-1) H2O(2分)
(3)Al3++3NH3·H2O=Al(OH)3↓+3NH4+ (4)2MgO·3SiO2·nH2O;(以上各1分)
2MgO·3SiO2·nH2O+4H+=2Mg2++3H2SiO3+(n-1) H2O(2分)
(1)溶液显浅黄色,所以一定含有Fe3+,则一定没有HCO3-。待测液和氢氧化钠溶液反应生成气体A,所以A是氨气,沉淀A是氢氧化铁;溶液A和盐酸酸化的氯化钡反应,所以B沉淀一定是硫酸钡,因此一定含有SO42-,则一定没有Ba2+。溶液B和硝酸酸化的硝酸银反应生成沉淀C,则C是氯化银,但由于前面加入铝盐酸,因此无法确定原溶液中是否含有氯离子;溶液C和氨水反应生成沉淀D,所以沉淀D一定是氢氧化铝,则原溶液中一定含有铝离子。因此钾离子和氯离子无法确定。
(2)用氧化物形式表示硅酸盐时,一般按照金属性强弱排列,最后是水。
(2)用氧化物形式表示硅酸盐时,一般按照金属性强弱排列,最后是水。

练习册系列答案
相关题目
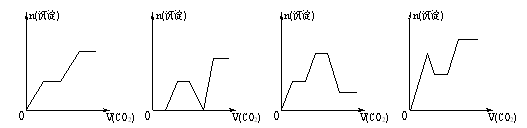
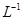
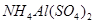 溶液中,滴加等浓度
溶液中,滴加等浓度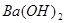 溶液x mL,下列叙述正确的是( )
溶液x mL,下列叙述正确的是( )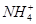 、
、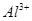 、
、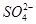 ,且
,且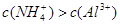
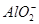 、
、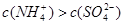
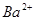 、
、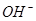 ,且
,且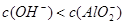
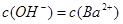

 回答下列问题:
回答下列问题: