题目内容
5.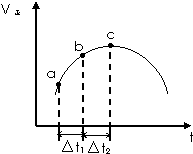 向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示.
向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示.(1)点a-c段,速率变化的主要原因是反应放热,温度升高,反应速率加快,点c后速率变化的主要原因是反应物浓度减小,反应速率减慢.
(2)c点是否已经达到平衡状态否(填“是”、“否”或“不一定”)
(3)反应物浓度:a点>b点(填“<”、“=”或“>”)
(4)反应物的总能量>生成物的总能量(填“<”、“=”或“>”)
(5)△t1=△t2时,SO2物质的量的变化量:a~b段<b~c段(填“<”、“=”或“>”)
分析 该反应是一个反应前后体积不变的可逆反应,容器的体积恒定、混合气体的物质的量的不变,所以压强对反应速率无影响,但温度和浓度影响其反应速率,结合图象可知反应速率先增大后减小,因为只要开始反应,反应物浓度就要降低,反应速率应该降低,但此时正反应却是升高的,这说明此时温度的影响是主要的,由于容器是绝热的,因此只能是正反应为放热反应,从而导致容器内温度升高反应速率加快.
解答 解:(1)从a到c正反应速率增大,之后正反应速率减小,说明反应刚开始时温度升高对正反应速率的影响大于浓度减小对正反应速率的影响,说明该反应为放热反应,
所以点a-c段,速率变化的主要原因是反应放热,温度升高,反应速率加快,点c后速率变化的主要原因是反应物浓度减小,反应速率减慢;故答案为:反应放热,温度升高,反应速率加快;反应物浓度减小,反应速率减慢;
(2)因为c点的速率仍然在减小,所以没有达到平衡状态,故答案为:否;
(3)虽然a到b时正反应速率增加,但反应物浓度随时间不断减小,所以反应物浓度:a点>b点,故答案为:>;
(4)由(1)解答,则该反应为放热反应,所以反应物的总能量高于生成物的总能量,故答案为:>;
(5)随着反应的进行,正反应速率越快,消耗的二氧化硫就越多,SO2的转化率将逐渐增大,所以SO2物质的量的变化量:a~b段<b~c段,故答案为:<.
点评 本题考查化学反应速率和平衡图象,注意该反应的特点及反应限制条件,一定要读懂,“绝热恒容密闭容器”这句话表达的含义,难度较大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.有机物:①正己烷 ②2-甲基丁烷 ③2-甲基丙烷 ④丙烷 ⑤乙烷它们的沸点按由高到低的顺序排列正确的是( )
| A. | ①>②>③>④>⑤ | B. | ⑤>④>③>②>① | C. | ①>②>④>③>⑤ | D. | ①>②>③>⑤>④ |
10.下列说法正确的是( )
| A. | 摩尔是表示物质粒子数量的单位 | B. | 物质的量可理解为物质的质量 | ||
| C. | 摩尔是表示物质的量的单位 | D. | 摩尔是七个基本物理量之一 |
14.金刚石和石墨是碳元素的两种结构不同的单质(同素异形体).在100kPa时,1mol石墨转化为金刚石,要吸收1.895kJ的热能.据此,试判断在100kPa压强下,下列结论正确的是( )
| A. | 石墨比金刚石稳定 | |
| B. | 金刚石比石墨稳定 | |
| C. | 1mol石墨比1mol金刚石的总能量高 | |
| D. | 1mol石墨和1mol金刚石的总能量相等 |
15.下列离子方程式书写正确的是( )
| A. | FeBr2溶液中通入少量Cl2:Fe2++Cl2═Fe3++2Cl- | |
| B. | 金属钠跟水反应2Na+2H2O═2Na++2OH-+H2↑ | |
| C. | 碳酸钡溶于醋酸BaCO3+2H+═Ba2++H2O+CO2↑ | |
| D. | 向NH4HSO4溶液中逐滴加入Ba(OH)2溶液至刚好沉淀完全Ba2++2OH-+NH4++H++SO42-═BaSO4↓+NH3•H2O+H2O |
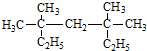 3,3,5,5-四甲基庚烷;
3,3,5,5-四甲基庚烷; 人们生产、生活和科研中离不开材料,下面是与材料有关的题目,请解答:
人们生产、生活和科研中离不开材料,下面是与材料有关的题目,请解答: