��Ŀ����
�״���Դ�ḻ���۸�������������淽�㣬��һ����Ҫ�Ļ���ԭ�ϣ�������Ҫ����;��Ӧ��ǰ����
��1����ҵ�����״��ij��÷����ǣ�CO(g)+2H2(g) ![]() CH3OH(g) ��H = ��90.8kJ/mol�����ں��º��ݵ������ڽ��з�ӦCO(g)+2H2(g)
CH3OH(g) ��H = ��90.8kJ/mol�����ں��º��ݵ������ڽ��з�ӦCO(g)+2H2(g) ![]() CH3OH(g)�����б�ʾ�÷�Ӧ�ﵽƽ��״̬�ı�־�� ������ĸ��ţ���
CH3OH(g)�����б�ʾ�÷�Ӧ�ﵽƽ��״̬�ı�־�� ������ĸ��ţ���
A�������л��������ܶȲ��仯
B��CO�ٷֺ������ֲ���
C�������л�������ѹǿ���仯
D����1��H��H�����ɵ�ͬʱ�� 3��C��H������
��2���Ƽ״�����Ҫ��H2���������з�Ӧ��ȡ��H2O(g)+CO(g) ![]() H2(g)+ CO2(g)
H2(g)+ CO2(g)
��H��0��ij�¶��¸÷�Ӧ��ƽ�ⳣ��K = 1������ʼʱc(CO)=1mol•L-1��c(H2O)=2mol•L��1���Իش��������⣺
�ٸ��¶��£���Ӧ����һ��ʱ����H2��Ũ��Ϊ0.5mol•L-1�����ʱ�÷�Ӧ
v(��) v(��)�����������������������
������Ӧ�¶Ȳ��䣬�ﵽƽ���H2O��ת����Ϊ ��
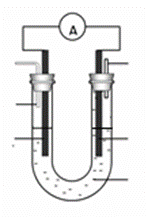
��3��ijʵ��С�����������ͼ��ʾ�ļ״�ȼ�ϵ��װ�á�
| ||||||||||
 | ||||||||||
| ||||||||||
| ||||||||||
�ٸõ�ع���ʱ��OH�� �� ���ƶ����a����b������
�ڹ���һ��ʱ������Һ��pH��С���õ�ظ����缫��ӦʽΪ ��
��1�� BC
��2���� > ��33.3%
��3���� b �� CH3OH+8OH����6e-=CO32��+6H2O

��15�֣��״���Դ�ḻ���۸�������������淽�㣬��һ����Ҫ�Ļ���ԭ�ϣ�������Ҫ����;��Ӧ��ǰ����
�Ź�ҵ�����״��ij��÷����ǣ�CO(g)+2H2(g) CH3OH(g) ��H����90.8 kJ/mol��
CH3OH(g) ��H����90.8 kJ/mol��
��֪��2H2(g)+ O2(g)= 2H2O (l) ��H����571.6 kJ/mol
H2(g) +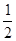 O2(g) = H2O(g) ��H����241.8 kJ/mol
O2(g) = H2O(g) ��H����241.8 kJ/mol
��H2��ȼ����Ϊ �� kJ/mol��
��CH3OH(g)��O2(g) CO(g)��2H2O(g)�ķ�Ӧ�ȡ�H�� �� ��
CO(g)��2H2O(g)�ķ�Ӧ�ȡ�H�� �� ��
�����ں��º��ݵ������ڽ��з�ӦCO(g)+2H2(g) CH3OH(g)����������жϸ÷�Ӧ�ﵽƽ��״̬�ı�־�� �� ��������ĸ��
CH3OH(g)����������жϸ÷�Ӧ�ﵽƽ��״̬�ı�־�� �� ��������ĸ��
| A��CO�ٷֺ������ֲ��� |
| B��������H2Ũ����COŨ����� |
| C�������л��������ܶȱ��ֲ��� |
| D��CO������������CH3OH������������� |
�ټ״��������������÷��е�һ����Ҫ��ӦΪCH3OH(g)
 CO(g)��2H2(g)���˷�Ӧ���Է����е�ԭ���� �� ��
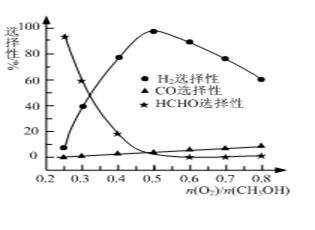
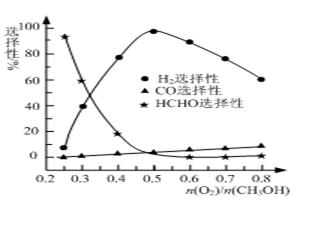
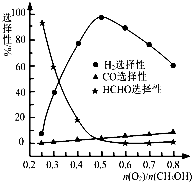
CO(g)��2H2(g)���˷�Ӧ���Է����е�ԭ���� �� �� �ڼ״���������������һ���¶�����Ag/CeO2��ZnOΪ����ʱԭ���������Է�Ӧ��ѡ���ԣ�ѡ����Խ��ʾ���ɵĸ�����Խ�ࣩӰ���ϵ��ͼ��ʾ����n(O2)/n(CH3OH)��0.25ʱ��CH3OH��O2��������Ҫ��Ӧ����ʽΪ �� �����Ʊ�H2ʱ��ÿ���n(O2)/n(CH3OH)�� �� ��
����ϡ��������У��״�ȼ�ϵ�ظ��������ĵ缫��ӦʽΪ �� ��
 ��2012?��ͷ��ģ���״���Դ�ḻ���۸�������������淽�㣬��һ����Ҫ�Ļ���ԭ�ϣ�������Ҫ����;��Ӧ��ǰ����
��2012?��ͷ��ģ���״���Դ�ḻ���۸�������������淽�㣬��һ����Ҫ�Ļ���ԭ�ϣ�������Ҫ����;��Ӧ��ǰ����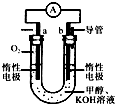 �״���Դ�ḻ���۸�������������淽�㣬��һ����Ҫ�Ļ���ԭ�ϣ�������Ҫ����;��Ӧ��ǰ����
�״���Դ�ḻ���۸�������������淽�㣬��һ����Ҫ�Ļ���ԭ�ϣ�������Ҫ����;��Ӧ��ǰ���� CH3OH(g)
��H = ��90.8kJ/mol��
CH3OH(g)
��H = ��90.8kJ/mol��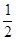 O2(g)=H2O(g)
��H = ��241.8kJ/mol��
O2(g)=H2O(g)
��H = ��241.8kJ/mol�� H2(g)+
CO2(g) ��H��0��ij�¶��¸÷�Ӧ��ƽ�ⳣ��K=1������ʼʱc(CO)=1mol•L-1��c(H2O)=2mol•L��1���Իش��������⣺
H2(g)+
CO2(g) ��H��0��ij�¶��¸÷�Ӧ��ƽ�ⳣ��K=1������ʼʱc(CO)=1mol•L-1��c(H2O)=2mol•L��1���Իش��������⣺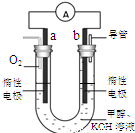
 CH3OH(g) ��H����90.8 kJ/mol��
CH3OH(g) ��H����90.8 kJ/mol�� O2(g)
= H2O(g) ��H����241.8 kJ/mol
O2(g)
= H2O(g) ��H����241.8 kJ/mol CO(g)��2H2O(g)�ķ�Ӧ�ȡ�H�� �� ��
CO(g)��2H2O(g)�ķ�Ӧ�ȡ�H�� �� ��