题目内容
甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景。
(1)工业生产甲醇的常用方法是:CO(g)+2H2(g)  CH3OH(g)
△H = —90.8kJ/mol。
CH3OH(g)
△H = —90.8kJ/mol。
已知:2H2(g)+O2(g)=2H2O(l) △H = —571.6kJ/mol;
H2(g)+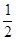 O2(g)=H2O(g)
△H = —241.8kJ/mol;
O2(g)=H2O(g)
△H = —241.8kJ/mol;
2CO(g)+O2(g)=2CO2(g) △H = —566.0kJ/mol
CH3OH(g) = CH3OH(l) △H = —37.3kJ/mol
①计算液体CH3OH的燃烧热为 。
②若在恒温恒容的容器内进行反应CO(g)+2H2(g)
 CH3OH(g),下列表示该反应达到平衡状态的标志有 (填字母序号)。
CH3OH(g),下列表示该反应达到平衡状态的标志有 (填字母序号)。
A.有1个H—H键生成的同时有 3个C—H键生成
B.CO百分含量保持不变
C.容器中混合气体的压强不变化
D.容器中混合气体的密度不变化
(2)制甲醇所需要的H2,可用下列反应制取:H2O(g)+CO(g)  H2(g)+
CO2(g) △H<0,某温度下该反应的平衡常数K=1。若起始时c(CO)=1mol•L-1,c(H2O)=2mol•L-1,试回答下列问题:
H2(g)+
CO2(g) △H<0,某温度下该反应的平衡常数K=1。若起始时c(CO)=1mol•L-1,c(H2O)=2mol•L-1,试回答下列问题:
①该温度下,反应进行一阶段时间后,测得H2的浓度为0.5mol•L-1,则此时该反应v(正) v(逆)(填“>”、“<”或“=”);
②若反应温度不变,达到平衡后,H2O的转化率为 。
(3)某实验小组设计了如右图7所示的甲醇燃料电池装置。
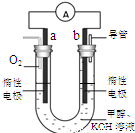
①该电池工作时,OH— 向 极移动(填“a”或“b”);
②工作一段时间后,测得溶液的pH减小,该电池负极反应的离子方程式为 。
(12分)
(1)726.5KJ/mol(2分) BC(2分)
(2)> (2分) 33.3% (2分)
(3)b(2分) CH3OH + 8OH- - 6e- = CO32- + 6H2O (2分)
【解析】
试题分析:
(1)①根据盖斯定律把方式程式进行加减运算,得出结果为726.5。②A应该是有2个H—H键生成的同时有 3个C—H键生成;D.容器中混合气体的密度始终不变化,无法做为判断依据;(2)①通过运用三态法计算出此温度下的平衡常数为K’=0.5*0.5/0.5*1.5=1/3<1,所以平衡正向移动,所以v(正)>v(逆)。②根据平衡常数K=1,运用三态法计算出H2O的转化率为33.3%。
(3)①该电池工作时,OH— 向负极移动,由于O2在正极参加反应,所以b极应该是负极。②负极中首先清楚是甲醇失去电子生成CO2,但由于电解质溶液呈碱性所以产物中应该有CO32-生成。所以电极反应式为CH3OH + 8OH- - 6e- = CO32- + 6H2O (2分)。
考点:考查盖斯定律,平衡状态的判断和电化学相关知识。

(15分)甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景。
⑴工业生产甲醇的常用方法是:CO(g)+2H2(g) CH3OH(g) △H=-90.8 kJ/mol。
CH3OH(g) △H=-90.8 kJ/mol。
已知:2H2(g)+ O2(g)= 2H2O (l) △H=-571.6 kJ/mol
H2(g) +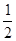 O2(g) = H2O(g) △H=-241.8 kJ/mol
O2(g) = H2O(g) △H=-241.8 kJ/mol
①H2的燃烧热为 ▲ kJ/mol。
②CH3OH(g)+O2(g) CO(g)+2H2O(g)的反应热△H= ▲ 。
CO(g)+2H2O(g)的反应热△H= ▲ 。
③若在恒温恒容的容器内进行反应CO(g)+2H2(g) CH3OH(g),则可用来判断该反应达到平衡状态的标志有 ▲ 。(填字母)
CH3OH(g),则可用来判断该反应达到平衡状态的标志有 ▲ 。(填字母)
| A.CO百分含量保持不变 |
| B.容器中H2浓度与CO浓度相等 |
| C.容器中混合气体的密度保持不变 |
| D.CO的生成速率与CH3OH的生成速率相等 |
①甲醇蒸汽重整法。该法中的一个主要反应为CH3OH(g)
 CO(g)+2H2(g),此反应能自发进行的原因是 ▲ 。
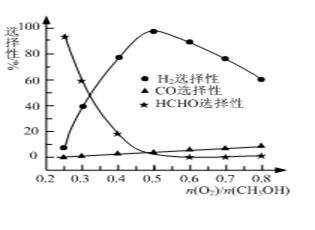
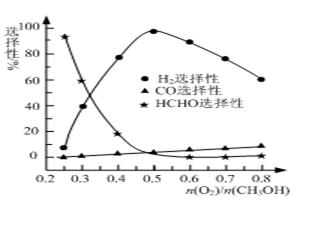
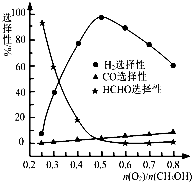
CO(g)+2H2(g),此反应能自发进行的原因是 ▲ 。 ②甲醇部分氧化法。在一定温度下以Ag/CeO2—ZnO为催化剂时原料气比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如图所示。则当n(O2)/n(CH3OH)=0.25时,CH3OH与O2发生的主要反应方程式为 ▲ ;在制备H2时最好控制n(O2)/n(CH3OH)= ▲ 。
⑶在稀硫酸介质中,甲醇燃料电池负极发生的电极反应式为 ▲ 。
 (2012?汕头二模)甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景.
(2012?汕头二模)甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景.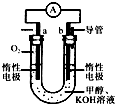 甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景.
甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景. CH3OH(g) △H=-90.8 kJ/mol。
CH3OH(g) △H=-90.8 kJ/mol。 O2(g)
= H2O(g) △H=-241.8 kJ/mol
O2(g)
= H2O(g) △H=-241.8 kJ/mol CO(g)+2H2O(g)的反应热△H= ▲ 。
CO(g)+2H2O(g)的反应热△H= ▲ 。