题目内容
 甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景.
甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景.(1)工业生产甲醇的常用方法是CO(g)+2H2(g)?CH3OH(g);△H=-90.8kJ?mol-1.
已知:2H2(g)+O2(g)═2H2O(l);△H=-571.6kJ?mol-1;
H2(g)+
| 1 | 2 |
2CO(g)+O2(g)═2CO2(g);△H=-566.0kJ?mol-1;
CH3OH(g)═CH3OH(l);△H=-37.3kJ?mol-1.
①计算液体CH3OH的燃烧热为
-1453/mol
-1453/mol
.②若在恒温恒容的容器内进行反应CO(g)+2H2(g)?CH3OH(g),下列表示该反应达到平衡状态的标志有
BC
BC
(填字母).A.有1个HH键生成的同时有3个CH键生成
B.CO百分含量保持不变
C.容器中混合气体的压强不变化
D.容器中混合气体的密度不变化
(2)制甲醇所需要的H2,可用下列反应制取:H2O(g)+CO(g)?H2(g)+CO2(g);△H<0.某温度下该反应的平衡常数K=1,若起始时c(CO)=1mol?L-1,c(H2O)=2mol?L-1,试回答下列问题:
①该温度下,反应进行一段时间后,测得H2的浓度为0.5mol?L-1,则此时该反应v(正)
>
>
(填“>”“<”或“=”)v(逆).②若反应温度不变,达到平衡后,H2O的转化率为
33.3%
33.3%
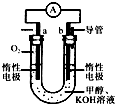
.(3)某实验小组设计了如图所示的甲醇燃料电池装置.
①该电池工作时,OH-向
b
b
(填“a”或“b”)极移动.②工作一段时间后,测得溶液的pH减小,该电池负极反应的电极反应式为
CH3OH+8OH--6e-=CO32-+6H2O
CH3OH+8OH--6e-=CO32-+6H2O
.分析:(1)①燃烧热是完全燃烧1mol物质生成最稳定的产物过程所放出的热量,据此书写热化学方程式;
②根据化学平衡状态的特征:逆、定、动、变、等来回答判断;
(2)①根据浓度熵和平衡常数K的关系来确定反应的方向,进而确定化学反应速率;
②根据三段式计算物质的转化率;
(3)燃料电池的工作原理:电池的负极一定是燃料发生失电子的氧化反应,在正极上一定是发生氧气得电子的还原反应.
②根据化学平衡状态的特征:逆、定、动、变、等来回答判断;
(2)①根据浓度熵和平衡常数K的关系来确定反应的方向,进而确定化学反应速率;
②根据三段式计算物质的转化率;
(3)燃料电池的工作原理:电池的负极一定是燃料发生失电子的氧化反应,在正极上一定是发生氧气得电子的还原反应.
解答:解:(1)①燃烧热是完全燃烧1mol物质生成最稳定的产物过程所放出的热量,液体CH3OH的燃烧的热化学方程式为:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l),根据盖斯定律,该反应与下列四个反应:
a、2H2(g)+O2(g)═2H2O(l);△H=-571.6kJ?mol-1;
b、CO(g)+2H2(g)?CH3OH(g);△H=-90.8kJ?mol-1;
c、2CO(g)+O2(g)═2CO2(g);△H=-566.0kJ?mol-1;
d、CH3OH(g)═CH3OH(l);△H=-37.3kJ?mol-1的关系为:
所求的反应=2a-2b+c-2d,所以液体CH3OH的燃烧热△H=2(-571.6kJ?mol-1)-2(-90.8kJ?mol-1)+(-566.0kJ?mol-1)-2(-37.3kJ?mol-1)=-1453KJ/mol,
故答案为:-1453KJ/mol;
②A.有1个H-H键生成的同时有3个C-H键生成,不能证明正逆反应速率相等,故A错误;
B.CO百分含量保持不变,证明达到了化学平衡状态,故B正确;
C.该反应是一个前后气体体积变化的反应,容器中混合气体的压强不变化,证明达到了平衡状态,故C正确;
D.混合气体质量守恒,体积恒定,所以容器中混合气体的密度不会发生变化,故D错误;
故选BC;
(2)①H2O(g)+CO(g)?H2(g)+CO2(g)
初始浓度:2 1 0 0
变化浓度:0.5 0.5 0.5 0.5
末态浓度:1.5 0.5 0.5 0.5
此时浓度熵Qc=
=
<1,即反应会正向进行,正反应速率大于逆反应速率,故答案为:大于;
②若反应温度不变,达到平衡后,设H2O的变化浓度为x,
H2O(g)+CO(g)?H2(g)+CO2(g)
初始浓度:2 1 0 0
变化浓度:x x x x
末态浓度:2-x 1-x x x
则
=1,解得x=
,所以水的转化率=
×100%≈33.3%,故答案为:33.3%;
(3)①燃料电池的工作原理:电池的负极一定是燃料发生失电子的氧化反应,在正极上一定是发生氧气得电子的还原反应,所以a为正极,b是负极,电解质里的阴离子移向电池的负极,所以该电池工作时,OH-向b极移动,故答案为:b;
②电池负极是燃料甲醇发生失电子的氧化反应,在碱性环境下,反应的电极反应式为CH3OH+8OH--6e-=CO32-+6H2O,故答案为:CH3OH+8OH--6e-=CO32-+6H2O.
a、2H2(g)+O2(g)═2H2O(l);△H=-571.6kJ?mol-1;
b、CO(g)+2H2(g)?CH3OH(g);△H=-90.8kJ?mol-1;
c、2CO(g)+O2(g)═2CO2(g);△H=-566.0kJ?mol-1;
d、CH3OH(g)═CH3OH(l);△H=-37.3kJ?mol-1的关系为:
所求的反应=2a-2b+c-2d,所以液体CH3OH的燃烧热△H=2(-571.6kJ?mol-1)-2(-90.8kJ?mol-1)+(-566.0kJ?mol-1)-2(-37.3kJ?mol-1)=-1453KJ/mol,
故答案为:-1453KJ/mol;
②A.有1个H-H键生成的同时有3个C-H键生成,不能证明正逆反应速率相等,故A错误;
B.CO百分含量保持不变,证明达到了化学平衡状态,故B正确;
C.该反应是一个前后气体体积变化的反应,容器中混合气体的压强不变化,证明达到了平衡状态,故C正确;
D.混合气体质量守恒,体积恒定,所以容器中混合气体的密度不会发生变化,故D错误;
故选BC;
(2)①H2O(g)+CO(g)?H2(g)+CO2(g)
初始浓度:2 1 0 0
变化浓度:0.5 0.5 0.5 0.5
末态浓度:1.5 0.5 0.5 0.5
此时浓度熵Qc=
| 0.5×0.5 |
| 1.5×0.5 |
| 1 |
| 3 |
②若反应温度不变,达到平衡后,设H2O的变化浓度为x,
H2O(g)+CO(g)?H2(g)+CO2(g)
初始浓度:2 1 0 0
变化浓度:x x x x
末态浓度:2-x 1-x x x
则
| x2 |
| (2-x)(1-x) |
| 2 |
| 3 |
| ||
| 2 |
(3)①燃料电池的工作原理:电池的负极一定是燃料发生失电子的氧化反应,在正极上一定是发生氧气得电子的还原反应,所以a为正极,b是负极,电解质里的阴离子移向电池的负极,所以该电池工作时,OH-向b极移动,故答案为:b;
②电池负极是燃料甲醇发生失电子的氧化反应,在碱性环境下,反应的电极反应式为CH3OH+8OH--6e-=CO32-+6H2O,故答案为:CH3OH+8OH--6e-=CO32-+6H2O.
点评:本题是一道关于化学反应速率、化学平衡、热化学、电化学等知识的综合考查题,考查学生分析和解决问题的能力,难度大.

练习册系列答案
相关题目
(15分)甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景。
⑴工业生产甲醇的常用方法是:CO(g)+2H2(g) CH3OH(g) △H=-90.8 kJ/mol。
CH3OH(g) △H=-90.8 kJ/mol。
已知:2H2(g)+ O2(g)= 2H2O (l) △H=-571.6 kJ/mol
H2(g) +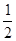 O2(g) = H2O(g) △H=-241.8 kJ/mol
O2(g) = H2O(g) △H=-241.8 kJ/mol
①H2的燃烧热为 ▲ kJ/mol。
②CH3OH(g)+O2(g) CO(g)+2H2O(g)的反应热△H= ▲ 。
CO(g)+2H2O(g)的反应热△H= ▲ 。
③若在恒温恒容的容器内进行反应CO(g)+2H2(g) CH3OH(g),则可用来判断该反应达到平衡状态的标志有 ▲ 。(填字母)
CH3OH(g),则可用来判断该反应达到平衡状态的标志有 ▲ 。(填字母)
| A.CO百分含量保持不变 |
| B.容器中H2浓度与CO浓度相等 |
| C.容器中混合气体的密度保持不变 |
| D.CO的生成速率与CH3OH的生成速率相等 |
①甲醇蒸汽重整法。该法中的一个主要反应为CH3OH(g)
 CO(g)+2H2(g),此反应能自发进行的原因是 ▲ 。
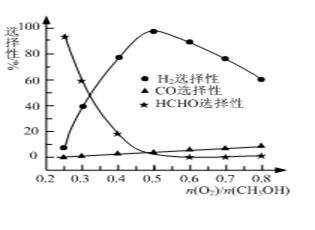
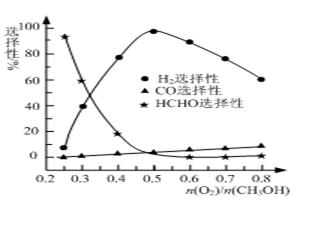
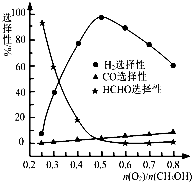
CO(g)+2H2(g),此反应能自发进行的原因是 ▲ 。 ②甲醇部分氧化法。在一定温度下以Ag/CeO2—ZnO为催化剂时原料气比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如图所示。则当n(O2)/n(CH3OH)=0.25时,CH3OH与O2发生的主要反应方程式为 ▲ ;在制备H2时最好控制n(O2)/n(CH3OH)= ▲ 。
⑶在稀硫酸介质中,甲醇燃料电池负极发生的电极反应式为 ▲ 。
 (2012?汕头二模)甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景.
(2012?汕头二模)甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景. CH3OH(g)
△H = —90.8kJ/mol。
CH3OH(g)
△H = —90.8kJ/mol。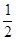 O2(g)=H2O(g)
△H = —241.8kJ/mol;
O2(g)=H2O(g)
△H = —241.8kJ/mol; H2(g)+
CO2(g) △H<0,某温度下该反应的平衡常数K=1。若起始时c(CO)=1mol•L-1,c(H2O)=2mol•L-1,试回答下列问题:
H2(g)+
CO2(g) △H<0,某温度下该反应的平衡常数K=1。若起始时c(CO)=1mol•L-1,c(H2O)=2mol•L-1,试回答下列问题: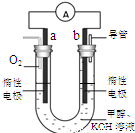
 CH3OH(g) △H=-90.8 kJ/mol。
CH3OH(g) △H=-90.8 kJ/mol。 O2(g)
= H2O(g) △H=-241.8 kJ/mol
O2(g)
= H2O(g) △H=-241.8 kJ/mol CO(g)+2H2O(g)的反应热△H= ▲ 。
CO(g)+2H2O(g)的反应热△H= ▲ 。