题目内容
(10)氧族元素的各种性质可归纳整理如下(部分):
回答下列问题:
(1)氧离子的结构示意图为 ,硫离子的电子式为 。
(2)碲的主要化合价可能有 。
(3)氧元素比硫无素非金属性 (填强和弱)。请用化学方程式证明该结论:
(4)H2O2可以作脱氯剂,用于消除水中的Cl2,写出该反应的化学方程式:
| 元素 性质 | 8O | 16S | Se | 52Te |
| 单质沸点(℃) | -183 | 444.6 | 685 | 1390 |
| 主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
| 原子半径(nm) | 0.074 | 0.102 | 0.116 | 0.143 |
| 单质与H2反应 | 点燃易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
(1)氧离子的结构示意图为 ,硫离子的电子式为 。
(2)碲的主要化合价可能有 。
(3)氧元素比硫无素非金属性 (填强和弱)。请用化学方程式证明该结论:
(4)H2O2可以作脱氯剂,用于消除水中的Cl2,写出该反应的化学方程式:
(1) 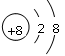 [ S ]2- (2)-2.、+4、+6
[ S ]2- (2)-2.、+4、+6
(3)强 O2+2H2S="2S" +2H2O (4)Cl2+H2O2=2HCl+O2
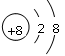 [ S ]2- (2)-2.、+4、+6
[ S ]2- (2)-2.、+4、+6(3)强 O2+2H2S="2S" +2H2O (4)Cl2+H2O2=2HCl+O2
(1)氧离子带2个负电荷,满足8电子稳定结构,结构示意图为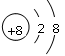 .硫离子带2个负电荷,也满足8电子稳定结构,电子式为
.硫离子带2个负电荷,也满足8电子稳定结构,电子式为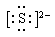 。
。
(2)依据同主族元素性质相似,可推断碲的主要化合价可能有-2.、+4、+6。
(3)可以利用单质间的相互置换来证明:O2+2H2S="2S" +2H2O。
(4)双氧水除具有氧化性外,还具有还原性,可被氯气氧化,从而消除水中的氯气,方程式为Cl2+H2O2=2HCl+O2。
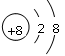 .硫离子带2个负电荷,也满足8电子稳定结构,电子式为
.硫离子带2个负电荷,也满足8电子稳定结构,电子式为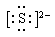 。
。(2)依据同主族元素性质相似,可推断碲的主要化合价可能有-2.、+4、+6。
(3)可以利用单质间的相互置换来证明:O2+2H2S="2S" +2H2O。
(4)双氧水除具有氧化性外,还具有还原性,可被氯气氧化,从而消除水中的氯气,方程式为Cl2+H2O2=2HCl+O2。

练习册系列答案
相关题目
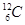 、
、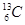 、
、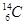 是碳的三种核素
是碳的三种核素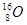 、
、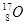 、
、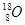 含有相同的中子数
含有相同的中子数