题目内容
【题目】工业上常用铝土矿(主要成分为Al2O3,SiO2和Fe2O3等杂质)为原料制备铝氢化钠,铝氢化钠(NaAlH4)是有机合成的重要还原剂,工艺流程如下:
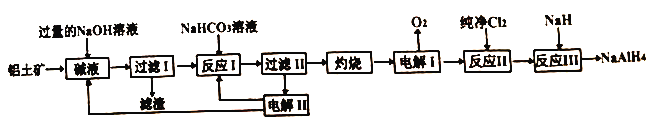 已知:SiO2在“碱液”中转化为铝硅酸钠Na2Al2SixO8)沉淀。
已知:SiO2在“碱液”中转化为铝硅酸钠Na2Al2SixO8)沉淀。
(1)过量NaOH溶液溶解铝土矿时为了提高浸出率可采取的措施是_______。(任写一种)
(2)电解I的化学方程式_______。
(3)“灼烧”操作用到的主要仪器有_______、_______、三脚架、玻璃棒、酒精灯、坩埚钳。
(4)“电解II”是电解Na2CO3溶液,原理如图所示。
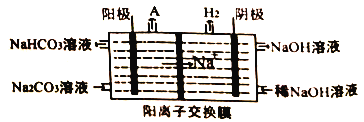
物质A为_______。(填化学式)
(5)反应III的化学方程式为_______,某同学经过分析认为可以再设计一个电解槽,电解_______ (填物质名称)溶液,更能实现副产物的循环利用。
(6)某同学认为该制备工艺也可以先酸溶,再加入NaOH溶液,当溶液中铁离子沉淀完全时,此时溶液pH是_______。(一般认为室温下离子浓度小于10-5mol/L时沉淀完全;Ksp[Fe(OH)3]=1×10-35,Ksp[Al(OH)3]=3×10-34)
【答案】 加热或粉碎矿石或适当增大NaOH溶液浓度 2Al2O3 ![]() 4Al+ 3O2↑ 坩埚 泥三角 O2 4NaH+AlCl3= NaAlH4+3NaCl 氯化钠 4
4Al+ 3O2↑ 坩埚 泥三角 O2 4NaH+AlCl3= NaAlH4+3NaCl 氯化钠 4
【解析】SiO2在“碱液”中转化为铝硅酸钠Na2Al2SixO8)沉淀,氧化铁与氢氧化钠不反应,氧化铝转化为偏铝酸钠,则过滤Ⅰ得到的滤渣是Na2Al2SixO8和Fe2O3。加入碳酸氢钠溶液,氢氧化钠转化为碳酸钠,偏铝酸钠转化为氢氧化铝沉淀和碳酸钠,过滤得到氢氧化铝,滤液是碳酸钠溶液;氢氧化铝灼烧转化为氧化铝,电解熔融氧化铝得到金属铝和氧气,铝与氯气化合生成氯化铝,氯化铝与NaH反应生成NaAlH4;则
(1)过量NaOH溶液溶解铝土矿时为了提高浸出率可采取的措施有:加热或粉碎矿石或适当增大NaOH溶液浓度等;(2)根据以上分析可知电解I的化学方程式为2Al2O3![]() 4Al+3O2↑。(3)“灼烧”固体氢氧化铝操作用到的主要仪器有坩埚、泥三角、三脚架、玻璃棒、酒精灯、坩埚钳。(4)阳极是氢氧根放电,则物质A为O2。(5)根据原子守恒可知反应III的化学方程式为4NaH+AlCl3=NaAlH4+3NaCl。由于反应中有氯化钠生成,电解氯化钠溶液生成氢气、氯气和氢氧化钠,更能实现副产物的循环利用。(6)根据氢氧化铁的溶度积常数可知当溶液中铁离子沉淀完全时,溶液中氢氧根的浓度是
4Al+3O2↑。(3)“灼烧”固体氢氧化铝操作用到的主要仪器有坩埚、泥三角、三脚架、玻璃棒、酒精灯、坩埚钳。(4)阳极是氢氧根放电,则物质A为O2。(5)根据原子守恒可知反应III的化学方程式为4NaH+AlCl3=NaAlH4+3NaCl。由于反应中有氯化钠生成,电解氯化钠溶液生成氢气、氯气和氢氧化钠,更能实现副产物的循环利用。(6)根据氢氧化铁的溶度积常数可知当溶液中铁离子沉淀完全时,溶液中氢氧根的浓度是![]() ,因此溶液pH是4。
,因此溶液pH是4。