题目内容
【题目】氢氧熔融碳酸盐燃料电池是一种高温电池(600﹣700℃),具有效率高、噪音低、无污染等优点。氢氧熔融碳酸盐燃料电池的工作原理如图所示。下列说法正确的是( )
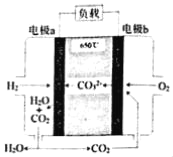
A.电池工作时,熔融碳酸盐只起到导电的作用
B.负极反应式为H2﹣2e﹣+CO32﹣═CO2+H2O
C.电子流向是:电极a﹣负载﹣电极b﹣熔融碳酸盐﹣电极a
D.电池工作时,外电路中流过0.2mol电子,消耗3.2gO2
【答案】B
【解析】
原电池工作时,H2失电子在负极反应,负极反应为H2+CO32--2e-=H2O+CO2,正极上为氧气得电子生成CO32-,则正极的电极反应为O2+2CO2+4e-=2CO32-。
A.分析可知电池工作时,熔融碳酸盐起到导电的作用,和氢离子结合生成二氧化碳,二氧化碳在正极生成碳酸根离子循环使用,故A错误;
B.原电池工作时,H2失电子在负极反应,负极反应为H2+CO32﹣﹣2e﹣=H2O+CO2,故B正确;
C,电池工作时,电子从负极电极a﹣负载﹣电极b,电子不能通过熔融碳酸盐重新回到电极a,故C错误;
D.电极反应中电子守恒正极的电极反应为O2+2CO2+4e﹣=2CO32﹣,电池工作时,外电路中流过0.2 mol电子,反应氧气0.05mol,消耗O2质量=0.05mol×32 g/mol=1.6g,故D错误;
故选:B。

【题目】化学是一门以实验为基础的学科,实验探究能激发学生学习化学的兴趣。某化学兴趣小组设计如图实验装置(夹持设备已略)制备氯气并探究氯气及其卤族元素的性质。回答下列问题:

(1)仪器a的名称是______________。
(2)A装置中发生的化学反应方程式为_________________________________。若将漂白粉换成KClO3,则反应中每生成21.3g Cl2时转移的电子数目为____NA。
(3)装置B可用于监测实验过程中C处是否堵塞,若C处发生了堵塞,则B中可观察到__________。
(4)装置C的实验目的是验证氯气是否具有漂白性,此时C中Ⅰ、Ⅱ、Ⅲ依次可放入____(填选项a或b或c)。
选项 | Ⅰ | Ⅱ | Ⅲ |
a | 干燥的有色布条 | 浓硫酸 | 湿润的有色布条 |
b | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
c | 湿润的有色布条 | 碱石灰 | 干燥的有色布条 |
(5)设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D中缓缓通入足量氯气时,可观察到无色溶液逐渐变为红棕色,说明氯的非金属性大于溴,打开活塞,将D中少量溶液加入E中,振荡E,观察到的现象是_______________________________,该现象_____(填“能”或“不能”)说明溴的非金属性强于碘,原因是_____________________。