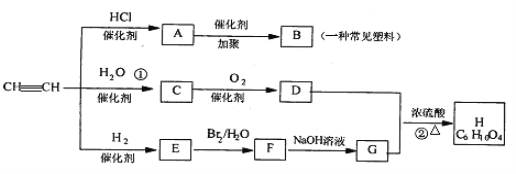
题目内容
【题目】半水煤气是工业合成氨的原料气,其主要成分为H2、CO、CO2、N2和H2O(g)。半水煤气经过下列步骤转化为合成氨的原料。
![]()
(1)步骤I,CO变换反应的能量变化如下图所示:

①CO变换反应的热化学方程式是________________。
②一定条件下,向体积固定的密闭容器中充入aL半水煤气,发生CO变换反应。测得不同温度(T1,T2)氢气的体积分数ψ(H2)与时间的关系如下所示。
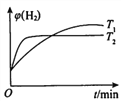
i.T1、T2的大小关系及判断理由是______________。
ii.请在上图中画出:其他条件相同时,起始充入0.5aL半水煤气,T2温度下氢气的体积分数ψ( H2)随时间的变化曲线。______________
(2)步骤Ⅱ,用饱和Na2CO3溶液作吸收剂脱除CO2时,初期无明显现象,后期有固体析出。
①溶液中离子浓度关系正确的是__________(选填字母)。
a.吸收前:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)
b.吸收初期:2c(CO32-)+2 c(HCO3-)+2c(H2CO3)=c(Na+)
c.吸收全进程:c(Na+)+c( H+)=2c(CO32-)+ c(HCO3-)+ c(OH-)
②后期析出固体的成分及析出固体的原因是___________。
③当吸收剂失效时,请写出一种可使其再生的方法(用化学方程式表示):____________。
【答案】 CO(g)+H2O(g)=CO(g)+H2(g) △H=-36kJ/mol T2>T1,相同条件下,温度越高反应速率越快,达到化学平衡状态的时间越短  ac 碳酸氢钠,碳酸氢钠的溶解度比碳酸钠的小,依据反应Na2CO3+CO2+H2O=2NaHCO3,水的质量减小,溶质质量增大 2NaHCO3
ac 碳酸氢钠,碳酸氢钠的溶解度比碳酸钠的小,依据反应Na2CO3+CO2+H2O=2NaHCO3,水的质量减小,溶质质量增大 2NaHCO3![]() Na2CO3+CO2+H2O
Na2CO3+CO2+H2O
【解析】(1)①根据图像可知,CO变换反应的热化学方程式是:CO(g)+H2O(g)=CO(g)+H2(g) △H=-2034 kJ/mol +1998 kJ/mol =-36kJ/mol;
②i.根据图像可知,先拐先平得知T2>T1,即原因为:相同条件下,温度越高反应速率越快,达到化学平衡状态的时间越短;ii.该反应为气体体积不变的反应,根据等效平衡可知,T2温度下,其他条件相同时,起始充入0.5aL半水煤气,为原反应物的一半,平衡时氢气的体积分数不变,浓度为原来的一半,反应速率减小,所需时间更长,故图像为: ;
;
(2)①a、吸收前为饱和Na2CO3溶液,是强碱弱酸盐,水解显碱性且二步水解,但水解是微弱的,故:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-),选项a正确;b、吸收前根据物料守恒有:2c(CO32-)+2 c(HCO3-)+2c(H2CO3)=c(Na+),吸收初期碳原子增加,故:2c(CO32-)+2 c(HCO3-)+2c(H2CO3)>c(Na+),选项b错误;c、吸收全进程的离子种类不变,根据电荷守恒都有:c(Na+)+c( H+)=2c(CO32-)+ c(HCO3-)+ c(OH-),选项c正确,答案选ac。②后期析出固体的成分为碳酸氢钠,依据反应Na2CO3+CO2+H2O=2NaHCO3,水的质量减小,溶质质量增大,而溶质碳酸氢钠的溶解度比碳酸钠的小,故析出碳酸氢钠晶体;③当吸收剂失效时,则全部转化为碳酸氢钠,将析出的晶体过滤后灼烧可得碳酸钠,其反应为:2NaHCO3![]() Na2CO3+CO2+H2O。
Na2CO3+CO2+H2O。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】用下图装置完成下列实验,不需要试管①(内盛有相应的除杂试剂)就能达到实验目的的是

实验目的 | ②中的试剂 | |
A | 检验碳与浓硫酸反应产生的气体中含有二氧化碳 | 澄清石灰水 |
B | 用碳酸钙与盐酸反应产生的气体验证碳酸的酸性强于苯酚 | 苯酚钠溶液 |
C | 验证乙醇在浓硫酸作用下发生消去反应产生的气体为不饱和烃 | 酸性高锰酸钾溶液 |
D | 验证石蜡油在碎瓷片上受热分解产生的气体中含有不饱和烃 | 溴的四氯化碳溶液 |
A. A B. B C. C D. D