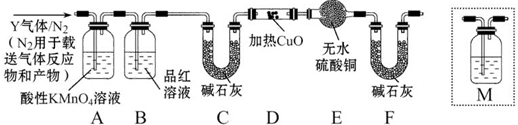
题目内容
16.在试管的内壁附着下列物质,用稀盐酸浸泡而不能除去的是( )| A. | 用足量一氧化碳还原氧化铁后留下的物质 | |
| B. | 硫酸铁溶液与氢氧化钠溶液反应后留下的红褐色固体 | |
| C. | 盛石灰水后留下的白色固体 | |
| D. | 用足量氢气还原氧化铜后留下的红色物质 |
分析 A.一氧化碳还原氧化铁后留下的物质是铁;
B.硫酸铁溶液与氢氧化钠溶液反应后留下的红褐色固体是氢氧化铁;
C.盛石灰水留下的白色固体是碳酸钙;
D.足量氢气还原氧化铜后留下的红色物质是铜.
解答 解:A.一氧化碳还原氧化铁后留下的物质是铁,铁能与盐酸反应,故A错误;
B.硫酸铁溶液与氢氧化钠溶液反应后留下的红褐色固体是氢氧化铁,能够和稀盐酸反应,故B错误;
C.盛石灰水留下的白色固体是碳酸钙,碳酸钙能与盐酸反应,故C错误;
D.足量氢气还原氧化铜后留下的红色物质是铜,是不活泼金属,排在金属活动性顺序中氢的后面,不能和稀盐酸反应,故D正确.
故选D.
点评 本题考查化学仪器的洗涤、干燥以及酸的性质,难度不大,明确物质的性质是解答本题的关键.

练习册系列答案
 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案
相关题目
6.下列说法中不正确的是( )
| A. | 体积相同、c(Na+)相等的纯碱溶液与小苏打溶液,分别与足量同种盐酸反应,消耗盐酸的体积相等 | |
| B. | 将铜粉加入氯化铁溶液,充分反应后,若固体有剩余,则该固体不可能含铁 | |
| C. | 用AlCl3溶液制取Al(OH)3,沉淀剂选用氨水比选用NaOH溶液好 | |
| D. | 相同质量的钠、镁、铝分别与足量的稀硫酸反应,生成气体的质量之比为27:24:23 |
7.Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量为3:4时,参加反应的Cu2S与HNO3的物质的量之比为( )
| A. | 1:8 | B. | 3:20 | C. | 3:22 | D. | 1:6 |
11.下列溶液中H+的物质的量浓度最大的是( )
| A. | 0.1mol/L的硫酸 | B. | 0.1mol/L的硝酸 | ||
| C. | 0.1mol/L的盐酸 | D. | 0.1mol/L的醋酸(CH3COOH) |
1.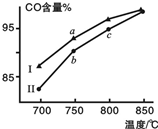 甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是:
甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是:
CH4(g)+H2O(g)=CO(g)+3H2(g)
其他条件相同,在不同催化剂(Ⅰ、Ⅱ)作用下反应相同时间后,体系中CO含量随反应温度的变化如图所示.下列说法正确的是( )
 甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是:
甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是:CH4(g)+H2O(g)=CO(g)+3H2(g)
其他条件相同,在不同催化剂(Ⅰ、Ⅱ)作用下反应相同时间后,体系中CO含量随反应温度的变化如图所示.下列说法正确的是( )
| A. | 相同条件下,催化剂Ⅱ催化效率更高 | |
| B. | b点表示上述反应在对应条件下的平衡状态 | |
| C. | 根据图象,无法判断该反应是否为吸热反应 | |
| D. | 该反应平衡常数表达式为K=$\frac{c(CO)•c3(H2)}{c(CH4)}$ |
17.表为元素周期表的一部分.
(1)表中元素F的非金属性最强;元素K的金属性最强;元素Br的单质室温下呈液态(填写元素符号);
(2)表中元素⑤的原子结构示意图是 ;
;
(3)表中元素⑥⑨⑩氢化物的稳定性顺序为HF>HCl>H2S(填化学式);
(4)表中元素⑨和⑩最高价氧化物对应水化物的酸性:HClO4>H2SO4(填化学式);
(5)表中元素②的最高价氧化物属于两性氧化物(选填“酸性氧化物、两性氧化物、碱性氧化物”).
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 一 | ① | ||||||
| 二 | ③ | ④ | ⑤ | ⑥ | |||
| 三 | ⑦ | ⑧ | ② | ⑨ | ⑩ | ||
| 四 | ⑪ | ⑫ | |||||
(2)表中元素⑤的原子结构示意图是
 ;
;(3)表中元素⑥⑨⑩氢化物的稳定性顺序为HF>HCl>H2S(填化学式);
(4)表中元素⑨和⑩最高价氧化物对应水化物的酸性:HClO4>H2SO4(填化学式);
(5)表中元素②的最高价氧化物属于两性氧化物(选填“酸性氧化物、两性氧化物、碱性氧化物”).