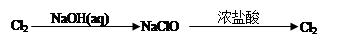题目内容
NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业。
(1)工业上可用氯化钠为原料,通过电解的方法制得NaClO,工业上制取NaClO的离子反应方程式为
电解后的溶液PH 7(填大于、小于、等于);其原因是 (用离子方程式表示)
(2)KAl(SO4)2溶液中质子守恒等式为
(3)某小组同学用下图所示装置探究饱和NaClO和KAl(SO4)2溶液混合反应的实验。
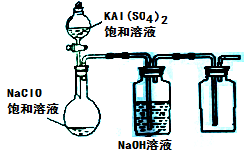
①打开活塞向烧瓶中加入饱和KAl(SO4)2溶液,产生大量的白色胶状沉淀。此时反应的离子方程式为
。
②将烧瓶中的混合液在阳光照射下,不久烧瓶中有黄绿色气体产生,充分反应后集气瓶中收集到一种无色无味的气体。写出在光照射下混合液中反应的化学方程式是 。
(4)若将分液漏斗中的KAl(SO4)2溶液换成硫酸亚铁铵(一种复盐:(NH4)2SO4·FeSO4)溶液,其他不变。打开分液漏斗活塞向烧瓶中滴入足量的硫酸亚铁铵溶液。观察到烧瓶中有红褐色沉淀产生,但是没有观察到黄绿色气体产生。此时烧瓶中发生的氧化还原反应的离子方程式为
。
(5)取100mL 0.1mol/L Ba(OH)2溶液,向其中逐滴加入同浓度的KHSO4溶液至Ba2+恰好完全沉淀,此时溶液的PH值为 (忽略两溶液混合时的体积变化,混合后溶液的温度为100℃,100℃时Kw=1x10-12)
(1)工业上可用氯化钠为原料,通过电解的方法制得NaClO,工业上制取NaClO的离子反应方程式为
电解后的溶液PH 7(填大于、小于、等于);其原因是 (用离子方程式表示)
(2)KAl(SO4)2溶液中质子守恒等式为
(3)某小组同学用下图所示装置探究饱和NaClO和KAl(SO4)2溶液混合反应的实验。

①打开活塞向烧瓶中加入饱和KAl(SO4)2溶液,产生大量的白色胶状沉淀。此时反应的离子方程式为
。
②将烧瓶中的混合液在阳光照射下,不久烧瓶中有黄绿色气体产生,充分反应后集气瓶中收集到一种无色无味的气体。写出在光照射下混合液中反应的化学方程式是 。
(4)若将分液漏斗中的KAl(SO4)2溶液换成硫酸亚铁铵(一种复盐:(NH4)2SO4·FeSO4)溶液,其他不变。打开分液漏斗活塞向烧瓶中滴入足量的硫酸亚铁铵溶液。观察到烧瓶中有红褐色沉淀产生,但是没有观察到黄绿色气体产生。此时烧瓶中发生的氧化还原反应的离子方程式为
。
(5)取100mL 0.1mol/L Ba(OH)2溶液,向其中逐滴加入同浓度的KHSO4溶液至Ba2+恰好完全沉淀,此时溶液的PH值为 (忽略两溶液混合时的体积变化,混合后溶液的温度为100℃,100℃时Kw=1x10-12)
(16分)(每空2分)(1)Cl-+H2O ClO-+H2↑ 大于 ClO-+H2O?HClO+OH-
ClO-+H2↑ 大于 ClO-+H2O?HClO+OH-
(2)c(H+)=c(OH-)+3c(Al(OH)3)
(3)①3Cl-+Al3++3H2O=3HClO+Al(OH)3↓②4HClO 2H2O+2Cl2↑+O2↑
2H2O+2Cl2↑+O2↑
(4)3ClO-+6Fe2++3H2O=2Fe(OH)3↓+4Fe3++3Cl-
(5)10.7
 ClO-+H2↑ 大于 ClO-+H2O?HClO+OH-
ClO-+H2↑ 大于 ClO-+H2O?HClO+OH-(2)c(H+)=c(OH-)+3c(Al(OH)3)
(3)①3Cl-+Al3++3H2O=3HClO+Al(OH)3↓②4HClO
 2H2O+2Cl2↑+O2↑
2H2O+2Cl2↑+O2↑(4)3ClO-+6Fe2++3H2O=2Fe(OH)3↓+4Fe3++3Cl-
(5)10.7
试题分析:(1)电解饱和食盐水得到氯气、氢气、氢氧化钠溶液,氯气和氢氧化钠溶液反应生成次氯酸钠和氯化钠溶液;氯气全部和氢氧化钠反应生成次氯酸钠溶液和氢气;次氯酸钠溶液水解显碱性;ClO-+H2O?HClO+OH-;(2)液中铝离子水解生成氢氧化铝和氢离子,质子守恒是水电离出的氢离子和氢氧根离子守恒,c(H+)=c(OH-)+3c(Al(OH)3);(3)①烧瓶中加入饱和KAl(SO4)2溶液,次氯酸根离子水解显碱性,铝离子水解显酸性,混合后水解相互促进,产生大量的白色胶状沉淀和次氯酸;②将烧瓶中的混合液在阳光照射下,不久烧瓶中有黄绿色气体产生为氯气,充分反应后集气瓶中收集到一种无色无味的气体为氧气.依据氧化还原反应电子守恒写出化学方程式并配平;(4)若将分液漏斗中的KAl(SO4)2溶液换成硫酸亚铁铵(一种复盐:(NH4)2SO4?FeSO4)溶液,其他不变.打开分液漏斗活塞向烧瓶中滴入足量的硫酸亚铁铵溶液.观察到烧瓶中有红褐色沉淀产生,但是没有观察到黄绿色气体产生,亚铁离子具有还原性,次氯酸根离子教育氧化性在溶液中发生氧化还原反应;(5)取100mL 0.1mol/L Ba(OH)2溶液,向其中逐滴加入同浓度的KHSO4溶液至Ba2+恰好完全沉淀,Ba(OH)2溶液与KHSO4溶液至Ba2+恰好完全沉淀,需要同浓度溶液体积为100ml,反应物质的量之比为1:1,剩余氢氧根离子物质的量为0.01mol,浓度c(OH-)=0.05mol/L;100℃时Kw=1x10-12,c(H+)=2×10-11mol/L;PH=-lg2×10-11mol/L="10.7."

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

 丙(g) + H2(g),得到如下数据:
丙(g) + H2(g),得到如下数据: