题目内容
将晶体X加热分解,可得A、B、D、E、F和水六种产物,其中A、B、D都是中学化学中常见的氧化物,气体E是单质F所含元素的氢化物。
(1)A能溶于强酸、强碱,写出A与强碱溶液反应的离子方程式_______________。
(2)B、D都是酸性氧化物且组成元素相同,D溶于水得强酸,则B、D分子中除氧元素外所含另一种元素在周期表中的位置是_______________。
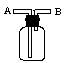
(3)E能使湿润的红色石蕊试纸变蓝,实验室制取E气体的化学方程式为________________,制得的气体可用如图所示装置收集,则气体应从_______(填“A”或“B”)通入。
(4)由各分解产物的物质的量之比推测X的组成类似于明矾,则其化学式为___________,若向X的浓溶液中滴加浓NaOH溶液至过量,现象依次为_______________ 、___________ _、
_____________ 。
(5)取一定量的X晶体分解,若生成F 1 mol,则必同时生成_______ 物质_____ mol。
(1)A能溶于强酸、强碱,写出A与强碱溶液反应的离子方程式_______________。
(2)B、D都是酸性氧化物且组成元素相同,D溶于水得强酸,则B、D分子中除氧元素外所含另一种元素在周期表中的位置是_______________。
(3)E能使湿润的红色石蕊试纸变蓝,实验室制取E气体的化学方程式为________________,制得的气体可用如图所示装置收集,则气体应从_______(填“A”或“B”)通入。

(4)由各分解产物的物质的量之比推测X的组成类似于明矾,则其化学式为___________,若向X的浓溶液中滴加浓NaOH溶液至过量,现象依次为_______________ 、___________ _、
_____________ 。
(5)取一定量的X晶体分解,若生成F 1 mol,则必同时生成_______ 物质_____ mol。
(1)Al2O3+2OH-=2AlO2-+H2O (2)第三周期,ⅥA族
(3)Ca(OH)2+2NH4Cl CaCl2+2NH3↑+2H2O; B
CaCl2+2NH3↑+2H2O; B
(4)NH4Al(SO4)2·12H2O;生成白色沉淀;生成刺激性气味的气体;白色沉淀又逐渐溶解
(5)SO2;3
(3)Ca(OH)2+2NH4Cl
 CaCl2+2NH3↑+2H2O; B
CaCl2+2NH3↑+2H2O; B(4)NH4Al(SO4)2·12H2O;生成白色沉淀;生成刺激性气味的气体;白色沉淀又逐渐溶解
(5)SO2;3
试题分析:(1)A能溶于强酸、强碱,且A是氧化物,所以A是氧化铝,氧化铝与强碱溶液反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O。
(2)B、D都是酸性氧化物且组成元素相同,D溶于水得强酸,所以B是SO2,D是三氧化硫,因此则B、D分子中除氧元素外所含另一种元素是硫,硫元素在周期表中的位置是第三周期第ⅥA族。
(3)E能使湿润的红色石蕊试纸变蓝,则E是氨气,实验室制取E气体的化学方程式为Ca(OH)2+2NH4Cl
 CaCl2+2NH3↑+2H2O。氨气密度小于空气的,所以用如图所示装置收集氨气时应该从B口通入。
CaCl2+2NH3↑+2H2O。氨气密度小于空气的,所以用如图所示装置收集氨气时应该从B口通入。(4)气体E是单质F所含元素的氢化物,所以F是氮气。即X分解产物是氧化铝、SO2、三氧化硫、氨气、氮气和水。又因为X的结构类似于明矾,所以根据明矾的化学式KAl(SO4)2·12H2O可知X的化学式为NH4Al(SO4)2·12H2O;向X的溶液中滴加浓氢氧化钠溶液,OH-首先结合Al3+生成白色沉淀氢氧化铝,然后与NH4+结合放出刺激性气味的气体氨气,最好再溶解氢氧化铝,白色沉淀消失,因此实验现象依次为生成白色沉淀;生成刺激性气味的气体;白色沉淀又逐渐溶解。
(5)X如果分解生成1mol氮气,则氮元素的化合价从-3价升高到0价,失去3个电子,即生成1mol氮气失去6mol电子。S元素的化合价从+6降低到+4价,得到2个电子,所以根据电子得失守恒可知生成SO2的物质的量是6mol÷2=3mol。2、三氧化硫性质;氨气制备;晶体化学式的确定以及氧化还原反应的计算等

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目