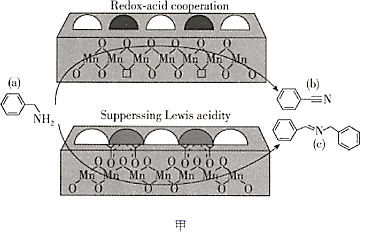
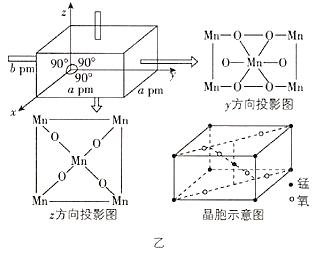
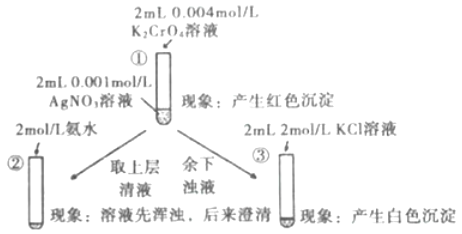
题目内容
【题目】一定质量的某铁的氧化物FexOy,与足量的4 mol·L-1硝酸溶液充分反应,消耗硝酸溶液700 mL,生成2.24 L NO(标准状况)。则该铁的氧化物的化学式为( )
A.FeOB.Fe2O3C.Fe3O4D.Fe4O5
【答案】C
【解析】
铁的氧化物FexOy与足量的4 mol·L-1硝酸溶液充分反应生成硝酸铁、一氧化氮和水,标准状况下,2.24 L NO的物质的量为0.1mol,700mL4 mol·L-1硝酸溶液中硝酸的物质的量为2.8mol,由N原子个数守恒可得3n(Fe3+)+ n(NO)= n(HNO3),3n(Fe3+)=2.8mol—0.1mol,n(Fe3+)=0.9mol,设FexOy中铁元素化合价为a,由得失电子数目守恒可得,n(3—a)×0.9mol=3×0.1mol,解得a=![]() ,由化合价代数和为零可得
,由化合价代数和为零可得![]() x=2y,则x:y=3:4,答案选C。
x=2y,则x:y=3:4,答案选C。

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案
相关题目