题目内容
【题目】图1是部分短周期元素的常见化合价与原子序数的关系图: 
(1)画出元素F的原子结构示意图 .
(2)从上述元素中选取两种元素形成既含离子键又含共价键的化合物,该化合物的电子式为 .
(3)这些元素中,最高价氧化物对应的水化物中酸性最强的化合物分子式为 .
(4)C、D、G对应的简单离子半径由小到大的顺序是 . (用离子符号回答)
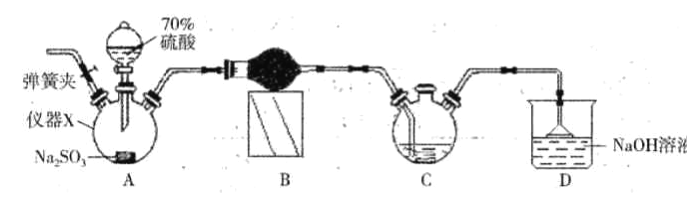
(5)某同学设计实验装置如图2,证明A、B、F的非金属性强弱关系:
①溶液a和溶液b分别为 , .
②溶液c中的离子反应方程式为 .
③请从原子结构的角度解释非金属性B>A的原因
(6)将1mol D2C2投入200mL 3mol/L EH3溶液中,
①转移电子的物质的量为 .
②用一个化学反应方程式表示该反应
【答案】
(1)![]()
(2)![]()
(3)HClO4
(4)Na+<O2﹣<S2﹣
(5)硝酸;饱和NaHCO3溶液;SiO32﹣+CO2+H2O=H2SiO3↓+CO32﹣;碳和氮元素处于同一周期,氮原子的核电荷数大于碳原子,原子半径较碳原子小,氮原子核对最外层电子的吸引力更大,得电子能力更强
(6)1mol;10Na2O2+6H2O+6AlCl3=2NaAlO2+4Al(OH)3↓+18NaCl+5O2
【解析】解:短周期元素中,A、F均有+4、﹣4价,处于ⅣA族,且原子序数A<F,故A为碳、F为Si;C、G均有﹣2价,且G有+6,G的原子序数较大,故C为O元素、G为S元素;B有+5、﹣3价,原子序数介于碳、氧之间,故B为N元素;H有+7、﹣1价,原子序数大于硫,则H为Cl;D有+1价,E有+3价,分别处于ⅠA族、ⅢA族,原子序数:氧<D<E<Si,故D为Na,E为Al.
(1.)Si原子核外电子数为14,有3个电子层,各层电子数为2、8、4,原子结构示意图为: ![]() ,所以答案是:
,所以答案是: ![]() ;
;
(2.)两种元素形成既含离子键又含共价键的化合物为Na2O2等,过氧化钠的电子式为 ![]() ,所以答案是:
,所以答案是: ![]() ;
;
(3.)这些元素中,最高价氧化物对应的水化物中酸性最强的化合物为HClO4 , 所以答案是:HClO4;
(4.)电子层结构相同的离子,核电荷数越大离子半径越小,离子的电子层越多离子半径越大,故离子半径:Na+<O2﹣<S2﹣ , 所以答案是:Na+<O2﹣<S2﹣;
(5.)由装置图可知,实验原理是利用强酸制备弱酸,硝酸易挥发,为防止干扰应除去,故锥形瓶中产生二氧化碳,应为硝酸与碳酸盐反应,溶液b吸收挥发的硝酸,应为饱和的碳酸氢钠,烧杯中应是二氧化碳与硅酸钠反应生成硅酸,①由上述分析可知,溶液a为硝酸,溶液b为饱和NaHCO3溶液,所以答案是:硝酸;饱和NaHCO3溶液;②溶液c中的离子方程式为:SiO32﹣+CO2+H2O=H2SiO3↓+CO32﹣ , 所以答案是:SiO32﹣+CO2+H2O=H2SiO3↓+CO32﹣;③碳和氮元素处于同一周期,氮原子的核电荷数大于碳原子,原子半径较碳原子小,氮原子核对最外层电子的吸引力更大,得电子能力更强,因此氮元素的非金属性强于碳元素,所以答案是:碳和氮元素处于同一周期,氮原子的核电荷数大于碳原子,原子半径较碳原子小,氮原子核对最外层电子的吸引力更大,得电子能力更强;
(6.)①Na2O2投 AlCl3溶液中,先与水生成氢氧化钠与氧气,反应中过氧化钠起氧化剂、还原剂作用,各占一半,起还原剂的过氧化钠中O元素化合价有﹣1升高为0价,故1molNa2O2费用转移电子为1mol× ![]() ×2×[0﹣(﹣1)]=1mol,所以答案是:1mol;②将1mol Na2O2投入200mL 3mol/L AlCl3溶液中,生成2mol NaOH、0.5mol氧气,AlCl3溶的物质的量为0.2L×3mol/L=0.6mol,1:4<n(AlCl3):n(NaOH)=3:10<1:3,故生成Al(OH)3、NaAlO2 , 溶液中溶质为偏铝酸钠、氯化钠,根据电荷守恒可知反应中n(AlO2﹣)=2mol﹣0.6mol×3=0.2mol,故n(AlO2﹣)=n(NaAlO2)=0.2mol,根据Al元素守恒可知,n[Al(OH)3]=0.6mol﹣0.2mol=0.4mol,故n[Al(OH)3]:n(NaAlO2):n(氧气)=0.4mol:0.2mol:0.5mol=4:2:5,反应方程式为:10Na2O2+6H2O+6AlCl3=2NaAlO2+4Al(OH)3↓+18NaCl+5O2 , 所以答案是:10Na2O2+6H2O+6AlCl3=2NaAlO2+4Al(OH)3↓+18NaCl+5O2 .
×2×[0﹣(﹣1)]=1mol,所以答案是:1mol;②将1mol Na2O2投入200mL 3mol/L AlCl3溶液中,生成2mol NaOH、0.5mol氧气,AlCl3溶的物质的量为0.2L×3mol/L=0.6mol,1:4<n(AlCl3):n(NaOH)=3:10<1:3,故生成Al(OH)3、NaAlO2 , 溶液中溶质为偏铝酸钠、氯化钠,根据电荷守恒可知反应中n(AlO2﹣)=2mol﹣0.6mol×3=0.2mol,故n(AlO2﹣)=n(NaAlO2)=0.2mol,根据Al元素守恒可知,n[Al(OH)3]=0.6mol﹣0.2mol=0.4mol,故n[Al(OH)3]:n(NaAlO2):n(氧气)=0.4mol:0.2mol:0.5mol=4:2:5,反应方程式为:10Na2O2+6H2O+6AlCl3=2NaAlO2+4Al(OH)3↓+18NaCl+5O2 , 所以答案是:10Na2O2+6H2O+6AlCl3=2NaAlO2+4Al(OH)3↓+18NaCl+5O2 .

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案