题目内容
【题目】(1)水的电离平衡曲线如下图所示。
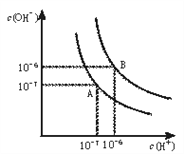
将100℃下的pH=8的Ba(OH)2溶液与100℃下的pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7, 则Ba(OH)2与盐酸的体积比为______________
(2)下列关于水电离的说法正确的是(____)
A.水电离是熵增加的反应,反应吸热,故能自发进行
B.升高温度水分子的活化分子数增多,有效碰撞几率减小,电离速率加快
C.向水中加入多电子体,加快H+和O2-之间的电子传递, 破坏水的电离平衡,是研究水分解的方向之一
D.水电离本质上是水分子间的氢键瞬间作用力加强造成的
【答案】 2:9 AD
【解析】(1)100℃时,Kw=10-12,pH=8的Ba(OH)2溶液中c(OH-)=10-4mol/L,pH=5的稀盐酸中c(H+)=10-5 mol/L,设氢氧化钡的体积为x,盐酸的体积为y,保持100℃的恒温,欲使混合溶液pH=7,溶液呈碱性,混合溶液中c(OH-)=![]() mol/L=10-5 mol/L,c(OH-)=
mol/L=10-5 mol/L,c(OH-)=![]() =10-5 mol/L,x:y=2:9,故答案为:2:9;
=10-5 mol/L,x:y=2:9,故答案为:2:9;
(2) A.水电离是熵增加的反应,电离过程需要吸热,即△S>0,△H>0,△G=△H-T△S,在一定温度下可以使得△G<0,能自发进行,故A正确;B.升高温度水分子的活化分子数增多,有效碰撞几率增大,电离速率加快,故B错误;C.水中不存在O2-,故C错误;D.水分子间的氢键瞬间作用力加强,使得氢氧共价键发生断裂,使水电离成氢离子和氢氧根离子,故D正确;故选AD。

练习册系列答案
 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目


