题目内容
(14分)
Ⅰ.(1)分析下表中各项的排布规律,按此规律排布第22项应为 。
(2)下列反应中属于取代反应的是 。(填序号)
①乙烯使酸性高锰酸钾溶液褪色 ②甲烷和氯气混合光照 ③苯使溴水层褪色
④乙酸和乙醇反应 ⑤乙醇变成乙醛 ⑥葡萄糖发生银镜反应
Ⅱ.A、B、C、D、E、F为原子序数依次增大的六种短周期元素。常温下,六种元素的常见单质中三种为气体,三种为固体。A与E,D与F分别同主族,A能与B、C、D分别形成电子数相等的三种分子,C、D的最外层电子数之和与E的核外电子总数相等。试回答下列问题:
(1)写出下列元素的元素符号: C ,F 。
(2)分子式为A2B2D4的化合物与含等物质的量的KOH的溶液反应后所得溶液呈酸性,其原因是 。(用方程式及必要的文字说明)。该溶液中各离子浓度由大到小的顺序为 。
(3)由A、C、D、F和Fe五种元素可组成类似明矾的化合物Z(相对分子质量为392),1molZ中含有6mol结晶水。对化合物Z进行如下实验:
a.取Z的溶液,加入过量的NaOH浓溶液并加热,产生白色沉淀和无色有刺激性气味的气体。白色沉淀迅速变为灰绿色,最终变为红褐色;
b.另取Z的溶液,加入过量的BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解。
①Z的化学式为 。
②已知100mL1mol/LZ溶液能与20mL1mol/LKMnO4溶液(硫酸酸化)恰好反应,写出该反应的离子方程式 。
Ⅰ.(1)分析下表中各项的排布规律,按此规律排布第22项应为 。
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| C2H4 | C2H6 | C2H6O | C2H4O2 | C3H6 | C3H8 | C3H8O | C3H6O2 | C4H8 | C4H10 |
①乙烯使酸性高锰酸钾溶液褪色 ②甲烷和氯气混合光照 ③苯使溴水层褪色
④乙酸和乙醇反应 ⑤乙醇变成乙醛 ⑥葡萄糖发生银镜反应
Ⅱ.A、B、C、D、E、F为原子序数依次增大的六种短周期元素。常温下,六种元素的常见单质中三种为气体,三种为固体。A与E,D与F分别同主族,A能与B、C、D分别形成电子数相等的三种分子,C、D的最外层电子数之和与E的核外电子总数相等。试回答下列问题:
(1)写出下列元素的元素符号: C ,F 。
(2)分子式为A2B2D4的化合物与含等物质的量的KOH的溶液反应后所得溶液呈酸性,其原因是 。(用方程式及必要的文字说明)。该溶液中各离子浓度由大到小的顺序为 。
(3)由A、C、D、F和Fe五种元素可组成类似明矾的化合物Z(相对分子质量为392),1molZ中含有6mol结晶水。对化合物Z进行如下实验:
a.取Z的溶液,加入过量的NaOH浓溶液并加热,产生白色沉淀和无色有刺激性气味的气体。白色沉淀迅速变为灰绿色,最终变为红褐色;
b.另取Z的溶液,加入过量的BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解。
①Z的化学式为 。
②已知100mL1mol/LZ溶液能与20mL1mol/LKMnO4溶液(硫酸酸化)恰好反应,写出该反应的离子方程式 。
(14分)
Ⅰ.(1)C7H16 (2分) (2)②④ (2分)
Ⅱ.(1)N、S (各1分)
(2)HC2O4- C2O4- + H+
C2O4- + H+
HC2O4-+H2O H2C2O4 + OH-
H2C2O4 + OH-
HC2O4-的电离程度大于水解程度,使溶液中C(H+) > C(OH-) ,所以KHC2O4溶液显酸性(2分)
c(K+)>c(HC2O4-)>c (H+) >c(C2O4-)>c(OH-) (2分)
(3)①(NH4)2Fe(SO4)2·6H2O (2分) ②5Fe2+ + MnO4- + 8H+ = 5Fe2+ + Mn2+ + 4H2O(2分)
Ⅰ.(1)C7H16 (2分) (2)②④ (2分)
Ⅱ.(1)N、S (各1分)
(2)HC2O4-
 C2O4- + H+
C2O4- + H+ HC2O4-+H2O
 H2C2O4 + OH-
H2C2O4 + OH-HC2O4-的电离程度大于水解程度,使溶液中C(H+) > C(OH-) ,所以KHC2O4溶液显酸性(2分)
c(K+)>c(HC2O4-)>c (H+) >c(C2O4-)>c(OH-) (2分)
(3)①(NH4)2Fe(SO4)2·6H2O (2分) ②5Fe2+ + MnO4- + 8H+ = 5Fe2+ + Mn2+ + 4H2O(2分)
试题分析:Ⅰ(1)此题为中档题,其实这道题更象是一个简单的数学题,不需要过多的化学知识,不过学生平时估计也碰到过这种找多少项为什么的类似题。有多种做法,比如我们把它分为4循环,22=4*5+2,也就是说第20项为C6H12O2,接着后面就是第22项为C7H16,这里面要注意的是第一项是从2个碳原子开始的。(2)取代反应是指有机化合物分子里的某些原子或原子团被其它原子或原子团所代替的反应。Ⅱ(1)A与E,D与F分别同主族,A能与B、C、D分别形成电子数相等的三种分子,可知A为H元素,E为Na元素,B为C元素,C为N元素,D为O元素,F为S元素。(2)A2B2D4为H2C2O4(草酸,弱酸),与等物质的量的KOH溶液反应的方程式为:H2C2O4+KOH=KHC2O4+H2O,溶液中含有HC2O4-,即水解HC2O4-+H2O
 H2C2O4 + OH-,也电离HC2O4-
H2C2O4 + OH-,也电离HC2O4-  C2O4- + H+,电离程度大于水解程度,使溶液中C(H+) > C(OH-) ,所以KHC2O4溶液显酸性,其各离子浓度由大到小的顺序为c(K+)>c(HC2O4-)>c (H+) >c(C2O4-)>c(OH-)。(3)①加入过量的NaOH浓溶液并加热,产生白色沉淀和无色有刺激性气味的气体,可推知Z中含有NH4+;白色沉淀迅速变为灰绿色,最终变为红褐色,可推知Z中含有Fe2+;加入过量的BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解,可推知Z中含有SO42-,结合化合物Z(相对分子质量为392),1molZ中含有6mol结晶水,可得Z的化学式为(NH4)2Fe(SO4)2·6H2O。②KMnO4溶液(硫酸酸化)具有强氧化性,把Fe2+氧化成Fe3+,其离子方程式为:5Fe2+ + MnO4- + 8H+ = 5Fe2+ + Mn2+ + 4H2O。
C2O4- + H+,电离程度大于水解程度,使溶液中C(H+) > C(OH-) ,所以KHC2O4溶液显酸性,其各离子浓度由大到小的顺序为c(K+)>c(HC2O4-)>c (H+) >c(C2O4-)>c(OH-)。(3)①加入过量的NaOH浓溶液并加热,产生白色沉淀和无色有刺激性气味的气体,可推知Z中含有NH4+;白色沉淀迅速变为灰绿色,最终变为红褐色,可推知Z中含有Fe2+;加入过量的BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解,可推知Z中含有SO42-,结合化合物Z(相对分子质量为392),1molZ中含有6mol结晶水,可得Z的化学式为(NH4)2Fe(SO4)2·6H2O。②KMnO4溶液(硫酸酸化)具有强氧化性,把Fe2+氧化成Fe3+,其离子方程式为:5Fe2+ + MnO4- + 8H+ = 5Fe2+ + Mn2+ + 4H2O。点评:酸式盐显酸性的,常见的只有这几个:硫酸氢盐、亚硫酸酸氢盐、磷酸二氢盐、草酸氢盐。把这几个记住就行了,其它的都是碱性的。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
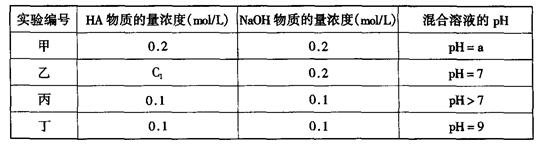 请回答:
请回答: