题目内容
(8分)已知某待测液由Ag+、Mg2+、K+、Ba2+、NH4+、NO3-中的若干种离子组成,进行如下实验:第一步:加入过量的稀盐酸,有白色沉淀生成。
第二步:过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成。
第三步:再过滤,取少量滤液,滴入NaOH溶液至溶液呈碱性,在此过程中溶液无明显现象,加热该溶液,可产生使湿润的红色石蕊试纸变蓝色的气体。
根据实验现象回答:
(1)写出第二步中所涉及的反应的离子方程式:
;
(2)待测液中一定含有 、NO3-离子,一定不含有 离子,还有一种离子不能确定其是否存在,要检验这种离子的实验方法是(填写实验名称和观察到的现象及结论,不要求写实验操作过程) , 。
第二步:过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成。
第三步:再过滤,取少量滤液,滴入NaOH溶液至溶液呈碱性,在此过程中溶液无明显现象,加热该溶液,可产生使湿润的红色石蕊试纸变蓝色的气体。
根据实验现象回答:
(1)写出第二步中所涉及的反应的离子方程式:
;
(2)待测液中一定含有 、NO3-离子,一定不含有 离子,还有一种离子不能确定其是否存在,要检验这种离子的实验方法是(填写实验名称和观察到的现象及结论,不要求写实验操作过程) , 。
(8分)(1) Ba2+ + SO42- = BaSO4↓
(2)一定含有 Ag+ Ba2+ NH4+ 、NO3-离子,一定不含有 Mg2+ 离子
焰色反应 ,透过蓝色钴玻璃片看是否有紫色
(2)一定含有 Ag+ Ba2+ NH4+ 、NO3-离子,一定不含有 Mg2+ 离子
焰色反应 ,透过蓝色钴玻璃片看是否有紫色
试题分析:加入过量的稀盐酸,有白色沉淀生成,则沉淀是氯化银,说明含有银离子;过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成,则沉淀是硫酸钡,说明含有Ba2+;再过滤,取少量滤液,滴入NaOH溶液至溶液呈碱性,在此过程中溶液无明显现象,说明没有镁离子。加热该溶液,可产生使湿润的红色石蕊试纸变蓝色的气体,该气体是氨气,所以含有NH4+。由于溶液是显中性的,所以一定含有NO3-,但钾离子不能确定。而要确定是否含有钾离子,则需要通过焰色反应,需要注意的是要通过蓝色的钴玻璃观察。
点评:进行物质的检验时,要依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断、推理、验证即可。

练习册系列答案
相关题目
 C6H6O6+2HI
C6H6O6+2HI 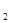 的溶液中,下列各组离子一定不能大量共存的是
的溶液中,下列各组离子一定不能大量共存的是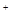 、Fe
、Fe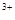 、SO
、SO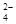 、Cl
、Cl
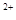 、Mg
、Mg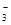 、NO
、NO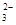
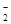 、OH
、OH