题目内容
10.1mol有机物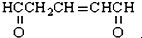 与足量的氢气和新制备的氢氧化铜反应,消耗的氢气与氢氧化铜的量分别为( )
与足量的氢气和新制备的氢氧化铜反应,消耗的氢气与氢氧化铜的量分别为( )| A. | 1 mol 2 mol | B. | 1 mol 4 mol | C. | 3 mol 2 mol | D. | 3 mol 4 mol |
分析 该分子中含有醛基和碳碳双键,具有醛和烯烃性质,能发生氧化反应、加成反应,醛基和碳碳双键能和氢气发生加成反应,醛基和新制氢氧化铜发生氧化反应,据此分析解答.
解答 解:该分子中含有醛基和碳碳双键,具有醛和烯烃性质,能发生氧化反应、加成反应,醛基和碳碳双键能和氢气发生加成反应,醛基和新制氢氧化铜发生氧化反应,1mol该物质和氢气发生加成反应最多需要3mol氢气,和新制氢氧化铜反应最多需要4mol氢氧化铜,故选D.
点评 本题考查有机物结构和性质,明确官能团及其性质关系是解本题关键,注意加成反应时不饱和键与氢气的计量数关系、醛基和氢氧化铜计量数关系,题目难度不大.

练习册系列答案
相关题目
1.下列说法正确的是( )
| A. | 某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则有机物的组成为一定CnH2n | |
| B. | 相同物质的量的烃,完全燃烧,生成的CO2越多,说明烃中的碳的百分含量越大 | |
| C. | 气态烃CxHy在O2充分燃烧,反应前后气体体积不变(温度>100℃),则y=4 | |
| D. | 相同质量的烃,完全燃烧,消耗O2越多,烃中碳的百分含量越高 |
18.下列实验目的能实现的是(部分夹持装置已略去)( )
| A. | 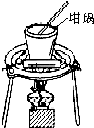 对溶液进行蒸发、浓缩、结晶 | |
| B. |  以己烯为萃取剂萃取溴水中的溴单质 | |
| C. | 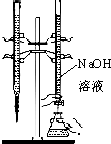 用已知浓度的氢氧化钠溶液滴定未知浓度的盐酸 | |
| D. | 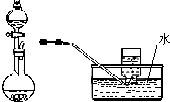 用稀硝酸与铜反应制取并收集NO |
5.已知反应A2(g)+2B2(g)?2AB2(g)△H<0,下列说法正确的( )
| A. | 升高温度,正向反应速率增加,逆向反应速率减小 | |
| B. | 升高温度有利于反应速率增加,从而缩短达到平衡的时间 | |
| C. | 若反应在密闭体系内进行,通入He气,体系压强增大,反应速率增大 | |
| D. | 若反应在恒压体系内进行,通往He气,体系压强不变,反应速率不变 |
2.下列体系中,离子能大量共存的是( )
| A. | 无色透明的酸性溶液:MnO4-、K+、C1-、SO42- | |
| B. | 使酚酞变红的溶液:K+、Na+、NO3-、Cl- | |
| C. | 滴加KSCN显红色的溶液:NH4+、K+、Cl-、I- | |
| D. | 0.1 mol•L-1NaHCO3溶液:Na+、Ba2+、NO3-、OH- |
19.下列叙述能证明金属A的金属性比金属B强的是( )
| A. | A原子的最外层电子数比B原子的最外层电子数少 | |
| B. | A原子的电子层数比B原子的电子层数少 | |
| C. | 1mol A从稀硫酸中置换的氢气比1mol B置换的氢气多 | |
| D. | 常温下,A能从冷水中置换出氢气,而B不能 |
20.下列离子晶体中,熔点最低的是( )
| A. | NaCl | B. | KCl | C. | CaO | D. | MgO |

 .
. 、、
、、 或
或 .
.