题目内容
【题目】计算:
(1)用14.2g无水硫酸钠配制成500mL溶液,其物质的量浓度为____mol·L-1。
(2)若从中取出50mL,其物质的量浓度为____mol·L-1;溶质的质量为___g。
(3)若将这50mL溶液用水稀释到100mL,所得溶液中Na+的物质的量浓度为____mol·L-1,SO42-的物质的量浓度为_____mol·L-1。
(4)已知:a g某气体A含有b个分子,则c g该气体在标准状况下的体积为____ L。
【答案】0.2 0.2 1.42 0.2 0.1 ![]()
【解析】
(1)根据n=m/M计算硫酸钠的物质的量,再根据c=n/V计算;
(2)溶液是均匀的,取出50mL溶液的浓度与原溶液浓度相等;含有溶质质量为原溶液中的1/10;
(3)根据稀释定律计算稀释后Na+、SO42-的物质的量浓度;
(4)根据ag气体的分子数为b,可知此气体的摩尔质量为M=NAag/bmol=a·NA/bg·mol-1.
(1)14.2g硫酸钠的物质的量=14.2g/142g·mol-1=0.1mol,溶于水配成500mL溶液,所得溶液物质的量浓度为0.1mol/0.5L=0.2mol·L-1;
(2)溶液是均匀的,取出50mL溶液的浓度与原溶液浓度相等为0.2mol·L-1;含有溶质质量为原溶液中的1/10,含有溶质的质量=14.2g×1/10=1.42g;
(3)根据稀释定律,稀释后Na+的物质的量浓度=0.2mol·L-1×2×0.05L/0.1L=0.2mol·L-1;SO42-的物质的量浓度=0.2mol·L-1×1×0.05L/0.1L=0.1mol·L-1;
(4)根据ag气体的分子数为b,可知此气体的摩尔质量为M=NAa g/b mol=a·NA/b g·mol-1,则c g该气体的物质的量n=m/M=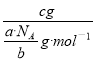 =bc/aNA mol,在标况下的体积为
=bc/aNA mol,在标况下的体积为![]() L。
L。

 阅读快车系列答案
阅读快车系列答案