题目内容
【题目】氨基甲酸铵(H2 NCOONH4)是一种白色晶体,是常见的实验药品,可由干燥的NH3和干燥的CO2在任何比例下反应得到每生成1.0g氨基甲酸铵放出2.05kJ的热量。回答下列问题:
(1)实验室可选用下列装置(I~V)制备干燥的NH3和CO2。

①用装置I、Ⅲ制备并纯化NH3时,接口a与________________(填接口字母)相连,装置I中发生反应的化学方程式为________________________。
②制备并纯化CO2时,按气流从左至右的方向,各接口连接顺序为________________(填接口字母)
(2)一种制备氨基甲酸铵的改进实验装置如下图所示:

①用仪器W代替分液漏斗的优点是________________________;用干冰装置代替(1)中制备并纯化CO2装置的优点是________________________。
②“薄膜反应器”中发生反应的热化学方程式为________________________;盛浓硫酸的装置的作用是________________________________(列举2点)。
③体系中若有水蒸气,还可能生成的铵盐是________________________(填化学式)。
【答案】d 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O bhgef 平衡压强,可使浓氨水一直顺利滴入三颈烧瓶 装置简单,产生的CO2不需净化和干燥(或气体的温度低有利于提高NH3和CO2的平衡转化率,答案合理即可 2NH3(g)+CO2(g)=H2NCOOONH4(s)△H=-159.90kJ·mol-1 吸收未反应的氨气、防止空气中水蒸气进入反应器、通过观察是否有气泡调节滴入氨水的速率等(答出两条合理的优点即可 (NH4)2CO2(或NH4HCO3)
CaCl2+2NH3↑+2H2O bhgef 平衡压强,可使浓氨水一直顺利滴入三颈烧瓶 装置简单,产生的CO2不需净化和干燥(或气体的温度低有利于提高NH3和CO2的平衡转化率,答案合理即可 2NH3(g)+CO2(g)=H2NCOOONH4(s)△H=-159.90kJ·mol-1 吸收未反应的氨气、防止空气中水蒸气进入反应器、通过观察是否有气泡调节滴入氨水的速率等(答出两条合理的优点即可 (NH4)2CO2(或NH4HCO3)
【解析】
根据装置图中各仪器的构造和作用分析解答;由题干信息计算反应热,进而书写热化学方程式。
(1)①为了使气体充分干燥,气体从大口通入,应的化学方程式为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O,
CaCl2+2NH3↑+2H2O,
故答案为:d,2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
②制备并纯化CO2时,先通过饱和碳酸氢钠溶液除去氯化氢,然后通入浓硫酸干燥,所以按气流从左至右的方向,各接口连接顺序为bhgef,
故答案为:bhgef;
(2) ①根据图中装置的构造可知,用仪器W代替分液漏斗的优点是:平衡压强,可使浓氨水一直顺利滴入三颈烧瓶;用干冰装置代替(1)中制备并纯化CO2装置的优点是:装置简单,产生的CO2不需净化和干燥,
故答案为:平衡压强,可使浓氨水一直顺利滴入三颈烧瓶;装置简单,产生的CO2不需净化和干燥;
②生成1.0g氨基甲酸铵放出2.05kJ的热量,则生成1mol放出的热量为159.90kJ,所以热化学方程式为:2NH3(g)+CO2(g)=H2NCOOONH4(s)△H=-159.90kJ·mol-1;盛浓硫酸的装置的作用是:吸收未反应的氨气、防止空气中水蒸气进入反应器、通过观察是否有气泡调节滴入氨水的速率等,
故答案为:2NH3(g)+CO2(g)=H2NCOOONH4(s)△H=-159.90kJ·mol-1;吸收未反应的氨气、防止空气中水蒸气进入反应器、通过观察是否有气泡调节滴入氨水的速率等;
③体系中若有水蒸气,可与二氧化碳反应生成碳酸,碳酸与氨气反应生成盐,所以还可能生成的铵盐是(NH4)2CO2(或NH4HCO3),
故答案为:(NH4)2CO2(或NH4HCO3)。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案【题目】硫氧化物易引起环境行染,需要悉心研究。
(1)二氧化硫可用于催化氧化制硫酸。硫酸工业中,作为催化剂的V2O5对反应I的催化循环过程经历了Ⅱ、Ⅲ两个反应阶段,如图所示:

下列分子中1mol化学键断裂时需要吸收的能量数据如下:
化学键 | S=O(SO2) | S=O(SO3) | O=O(O2) |
能量/kJ | 535 | a | 496 |
反应Ⅰ的△H=-98 kJ ·mol-1,则 a=____________。反应Ⅲ的化学方程式为______________。将2molSO2和1molO2充入密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g)![]() 2SO3(g)。平衡时SO3的体积分数(% )随温度和压强的变化如表所示:下列判断正确的是(_____________)
2SO3(g)。平衡时SO3的体积分数(% )随温度和压强的变化如表所示:下列判断正确的是(_____________)
压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
350 | 5.0 | a | b |
415 | c | 40.0 | d |
550 | e | f | 36.0 |
A.b >e
B.415℃、2.0MPa时O2的转化率为60%
C.在一定温度和压强下,加入V2O5作催化剂能加快反应速率,提高SO3的体积分数
D.平衡常数K(550℃)>K(350℃)
(2)较纯的SO2,可用于原电池法生产硫酸。图中离子交换膜是________离子交换膜(填“阴”、“阳”)。

(3)研究发现,含碱式硫酸铝的溶液与SO2结合的方式有2种:其一是与溶液中的水结合。其二是与碱式硫酸铝中的活性Al2O3结合,通过酸度计测定吸收液的pH变化,结果如右图所示:

请解释曲线如图变化的原因_______________________________。
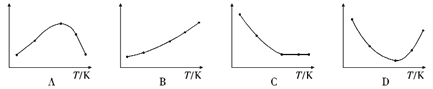
(4)取五等份SO3,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:3SO3(g)![]() (SO3)3(g) △H<0,反应相同时间后,分别测定体系中SO3的百分含量,并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是(_____)
(SO3)3(g) △H<0,反应相同时间后,分别测定体系中SO3的百分含量,并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是(_____)
(5)用Na2SO3溶液作为吸收液吸收SO2时,产物为NaHSO3,已知亚硫酸的两级电离平衡常数分别为Ka1、Ka2。则常温下NaHSO3溶液显酸性的充要条件为_____________。(用含为Ka1、Ka2的代数式表示)