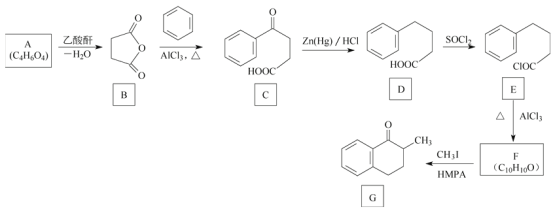
题目内容
【题目】燃煤产生的烟气中含有较多的CO2、CO、SO2等影响环境的气体。如何综合利用这些气体一直是科研单位研究的热点。
(1)已知:2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g) ΔH1
CO(g)+H2O(g)CO2(g)+H2(g) ΔH2
2CO(g)+4H2(g)CH3OCH3(g)+H2O(g) ΔH3
用ΔH2、ΔH3表示ΔH1,ΔH1=_________。
(2)针对CO2与H2反应转化为二甲醚(g)和H2O(g),研究发现,该反应中CO2的平衡转化率随反应温度、投料比[n(H2)/n(CO2)]的变化曲线如图:
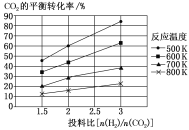
①ΔH1________(填“>”或“<”)0。
②若其他条件不变,仅仅增大压强,则逆反应速率会________(填“增大”“减小”或“不变”,下同),平衡常数K会________。
(3)研究发现,催化剂可以促使烟气CO、SO2转化为CO2、S。反应原理为2CO(g)+SO2(g)2CO2(g)+S(l) ΔH=-270 kJ·mol-1。
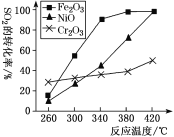
①其他条件相同,研究发现,分别选取Fe2O3、NiO、Cr2O3作上述反应的催化剂时,SO2的转化率随反应温度的变化如图,研究得出,应该选择Fe2O3作催化剂,主要原因可能是________________
②若在2 L恒容密闭容器中,将3mol CO、1 mol SO2混合,在一定条件下引发反应,当SO2的平衡转化率为40%时,此时K=________。
③向反应容器中再分别通入下列气体,可以使SO2转化率增大的是_____(填字母)。
A.CO B.SO2 C.N2 D.H2S E.CO2
【答案】ΔH3-2ΔH2 < 增大 不变 Fe2O3作催化剂时,在相对较低的温度下可获得较高的SO2转化率,从而节约能源 0.44 A
【解析】
(1)反应2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g) ΔH1
CO(g)+H2O(g)CO2(g)+H2(g) ΔH2
2CO(g)+4H2(g)CH3OCH3(g)+H2O(g) ΔH3
根据盖斯定律将①+2×②=③,可得反应2CO(g)+4H2(g)CH3OCH3(g)+H2O(g) △H3,以此计算△H1;
(2)①观察图象,随温度升高,CO2的平衡转化率逐渐减小,结合平衡移动原理可知该反应为吸热还是放热反应;
②结合反应速率、平衡常数的影响因素回答即可;
(3)①条件的选择关键在于在使用较低成本,较少时间,而能够达到较高转化率;
②已知起始量3 mol CO、1 molSO2,SO2的平衡转化率为40%,代入三段式即可求出各物质平衡量,即可求出K;
③结合平衡移动影响因素选择恰当的物质。
(1)反应2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g) ΔH1
CO(g)+H2O(g)CO2(g)+H2(g) ΔH2
2CO(g)+4H2(g)CH3OCH3(g)+H2O(g) ΔH3
根据盖斯定律将①+2×②=③,可得反应2CO(g)+4H2(g)CH3OCH3(g)+H2O(g)△H3,故△H3=2×△H2+△H1,
所以△H1=ΔH3-2ΔH2,
故答案为:ΔH3-2ΔH2;
(2)①由图可知,升高温度,CO2的平衡转化率降低,则正反应为放热反应,△H1<0,
故答案为:<;
②增大压强,正逆反应速率均增大,K只与温度有关,平衡常数K不变,
故答案为:增大;不变;
(3)①选择Fe2O3作催化剂,原因是在相对较低的温度下可获得较高的SO2转化率,从而节约能源,
故答案为:Fe2O3作催化剂时,在相对较低的温度下可获得较高的SO2转化率,从而节约能源;
②将3molCO、1molSO2,因为SO2的平衡转化率为40%,则△n(SO2)=1mol×40%=0.4mol,将数据代入三段式:

则平衡时c(CO)=2.2mol÷2L=1.1mol/L,c(SO2)=0.6mol÷2L=0.3mol/L,c(CO2)=0.8mol÷2L=0.4mol/L,
K=![]() =0.4408,
=0.4408,
故答案为:0.4408;
③反应原理为2CO(g)+SO2(g)2CO2(g)+S(l) ,
A. 增加CO浓度,可以使平衡正向移动,进而使SO2转化率增大,故A正确;
B. 增加SO2浓度,可以使平衡正向移动,但使SO2转化率减小,故B错误;
C. 增加N2浓度,可对平衡无影响,故C错误;
D. 增加H2S浓度,H2S与SO2反应,可以使平衡逆向移动,使SO2转化率减小,故D错误;
E. 增加CO2浓度,可以使平衡逆向移动,使SO2转化率减小,故E错误;
故答案为:A。

 阅读快车系列答案
阅读快车系列答案【题目】对于下列实验现象的解释,不合理的是
实验 | 现象 | 解释 | |
A | | ②中产生气体的速率比①慢 | 乙醇分子中,乙基对羟基产生影响,使O—H键不容易断裂 |
B |
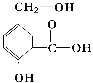
| ③中振荡静置后分层,上层为橙色;④中产生白色沉淀 | 苯酚分子中,苯环对羟基产生影响,使O—H键更容易被取代 |
C |
| ⑤中振荡静置后分层,下层为紫色溶液;⑥中振荡后紫色溶液褪色 | 甲苯分子中,苯环对甲基产生影响,使甲基上C—H更容易被氧化 |
D |
| 水浴加热,⑦中未见明显变化;⑧中试管壁上附着一层光亮的银 | 碱性条件下+1价的Ag才能氧化乙醛 |
A. A B. B C. C D. D