��Ŀ����
����Ŀ��Ī�����������ε�һ�ָ��Σ���һ����Ҫ�Ļ�ѧ�Լ�������ˮ��Һ�м���KSCN���Ժ�ɫ��������ͼ��ʾ�ķ�Ӧ��
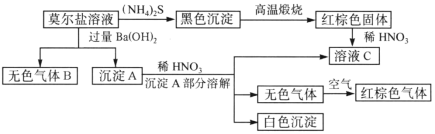
�������Ϲ�ϵ����Ҫ����գ�
(1)���ü�������B__________________��
(2)Ī���εĻ�ѧʽΪ____________________��
(3)���ֳ���A��ϡHNO3��Ӧ�����ӷ���ʽ��_____________________��
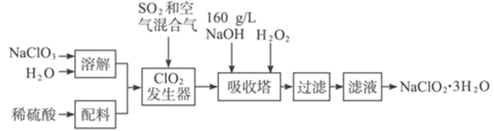
(4)�Ŵ�������Ʒ��Ǹ������������̷�(FeSO4��7H2O)����������ȴ���Ƶ�һ����ɫճ����Һ�����̷�������ʣ��Ĺ���Ϊ����ɫ������֪SO3���۵���16.8��C���е���44.8��C���ټӷ����ȷֽ�IJ��

��װ�õ�����˳��Ϊ______________��
��B����������֤�÷�Ӧ��ˮ���ɣ����е��Լ�Ϊ_________��ʵ������з���F����Һ��ɫ��D�г�����ɫճ��Һ�壬�������̷��ķ�Ӧ����ʽΪ_____________��
���𰸡�ʪ���ɫʯ����ֽ�� Fe(NH4)2(SO4)2��FeSO4��(NH4)2SO4 3Fe(OH)2+10H++NO3-=3Fe3++NO��+8H2O ABDEFC CuSO4 2FeSO47H2O![]() Fe2O3+SO2��+ SO3��+ 14H2O
Fe2O3+SO2��+ SO3��+ 14H2O
��������
Ī�����������ε�һ�ָ��Σ�˵�����к���SO42-����Ħ������Һ�м���(NH4)2S��������ɫ�������������ոó������õ�����ɫ���壬�ú���ɫ������Fe2O3������FeԪ���غ㣬��֪Ī�����к���FeԪ�أ�������Ī������Һ�м���KSCN���Ժ�ɫ��˵�����е�Fe����Fe3+����ʹFe2+��Fe2O3�����ᷴӦ������ҺC��CΪFe(NO3)3����Ī������Һ�м������Ba(OH)2��Һ����Ӧ������ɫ����B��NH3��˵��Ī�����к���NH4+��ͬʱ�õ���������A���ó�����BaSO4��Fe(OH)2�Ļ��������A�м���ϡHNO3��Fe(OH)2�����ᷢ��������ԭ��Ӧ����Fe(NO3)3��NO��H2O��BaSO4������ˮҲ�������ᣬ��˿������������ܽ⣬�õ���ҺC��ͬʱ������ɫ���壬�������������Ϊ����ɫ������ɫ������NO����Ī�����������ε�һ�ָ��Σ���˸��ݻ�������Ԫ�ػ��ϼ۴����͵���0����֪����ΪFe(NH4)2(SO4)2��д��FeSO4��(NH4)2SO4��
(4)��װ��A�м����̷���ͨ��װ��B��֤H2O�IJ�������װ��D��SO3����������ˮ��Ӧ�������ᣬE�������Ƿ�ֹ��������ķ�����Ȼ��ͨ��F��֤SO2�IJ�����������NaOH�ܹ�����SO2�������к���������ʽ���β���������ٽ��Ԫ���غ㡢�����غ㣬�ɵ÷�Ӧ����ʽ��
(1)����B��NH3�����鷽����������ʪ���ɫʯ����ֽ�ȿ���������ֽ��Ϊ��ɫ��֤��������ΪNH3�����ò�����պȡŨ��������������̣�Ҳ֤����������NH3��
(2)��������������֪Ī���λ�ѧʽΪFe(NH4)2(SO4)2��д��FeSO4��(NH4)2SO4��
(3)���ֳ���A���������ܽ���A�е�Fe(OH)2��HNO3����������ԭ��Ӧ������Fe(NO3)3��NO��H2O�����ݵ����غ㡢����غ㡢ԭ���غ㣬������ʲ��ԭ�ɵø÷�Ӧ�����ӷ���ʽ��3Fe(OH)2+10H++NO3-=3Fe3++NO��+8H2O��
(4)�ٽ��̷�����װ��A�У��þƾ���Ƽ���ʹ֮�����ֽⷴӦ������װ��B����ˮCuSO4�ɼ���H2O�IJ�������������SO3���۵���16.8��C���е���44.8��C����������װ��D���������£�SO3��ˮ��Ӧ����H2SO4��Ϊ��ֹ�������ڽ���ʹװ��������ѹǿ���Ͷ�����������ķ������������پ�װ��E�Ļ������ã�Ȼ��ͨ��װ��F����SO2�IJ�����SO2���ж����壬�ᵼ�´�����Ⱦ��������β��ͨ��װ��C��NaOH����β��������������װ�õ�����˳��ΪABDEFC��
��B����������֤�÷�Ӧ��ˮ���ɣ����е��Լ�Ϊ��ˮCuSO4��ʵ������з���F����Һ��ɫ��֤��������SO2��D�г�����ɫճ��Һ�壬˵��D�в�����H2SO4�����̷��ֽ������SO3��ˮ��Ӧ�����ģ�װ��A��ʣ��Ĺ���Ϊ����ɫ���ù���ΪFe2O3���������̷��ķ�Ӧ����ʽ�̷����ȷ�Ӧ������H2O��SO2��SO3��Fe2O3���÷�Ӧ�ķ���ʽΪ��2FeSO47H2O![]() Fe2O3+SO2��+ SO3��+ 14H2O��
Fe2O3+SO2��+ SO3��+ 14H2O��

����Ŀ��ʵ������ijЩ�������ȡ���ռ���β������װ����ͼ��ʾ��ʡ�Լгֺ;���װ�ã������ô�װ�úͱ����ṩ������������ʵ�飬�������ѡ����

ѡ�� | a�е����� | b�е����� | c���ռ������� | d�е����� |
A | Ũ��ˮ | CaO | NH3 | H2O |
B | ϡ���� | Na2SO3 | SO2 | NaOH��Һ |
C | ϡ���� | Cu | NO2 | H2O |
D | Ũ���� | KMnO4 | Cl2 | NaOH��Һ |
A.AB.BC.CD.D
����Ŀ��̼��������Ļ����������������й㷺���ڡ���ش�
��1����CO2��NH3Ϊԭ�Ͽɺϳɻ�������[CO(NH2)2]����֪��
��2NH3(g)+CO2(g)=NH2CO2NH4(s) ��H=-l59.5kJ��mol-1
��NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l) ��H=-160.5kJ��mol-1
д��CO2��NH3�ϳ����غ�Һ̬ˮ���Ȼ�ѧ��Ӧ����ʽ__��
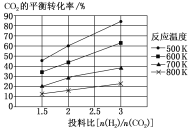
��2��T�¶�ʱ���ݻ�Ϊ2L�ĺ����ܱ�������ֻ����1.00molNO2���巢����Ӧ��2NO(g)+O2(g)![]() 2NO2(g) H<0����ͬʱ�̲��������n(NO2)���±���
2NO2(g) H<0����ͬʱ�̲��������n(NO2)���±���
ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
�������¶�Kֵ___������С����T�¶�ʱ��ѧƽ�ⳣ��K=___mol-1��L
�ڴ�0��2s�÷�Ӧ��ƽ������v(NO2)=___��
�۶Կ��淴Ӧ2NO(g)+O2(g)![]() 2NO2(g) H<0�����£������ܱ������У�����˵���У���˵���÷�Ӧ�ﵽ��ѧƽ��״̬����___��
2NO2(g) H<0�����£������ܱ������У�����˵���У���˵���÷�Ӧ�ﵽ��ѧƽ��״̬����___��
A.���������ܶȲ��ٱ仯
B.��������ѹǿ���ٱ仯
C.������ת���ʲ��ٱ仯
D.N2��O2��NO�����ʵ���֮��Ϊ1:1:2
��3�������£���SO2��NaOH��Һ��Ӧ�ɵõ�NaHSO3��Na2SO3�ȡ�
����֪Na2SO3ˮ��Һ�Լ��ԣ�ԭ����___(д����Ҫ��Ӧ�����ӷ���ʽ)������Һ�У�c(Na+)___2c(SO32-)+c(HSO3-)(����������������������)��
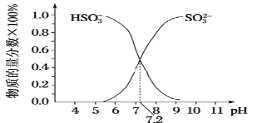
����ijNaHSO3��Na2SO3�����Һ��HSO3-��SO32-���ʵ���������pH�仯������ͼ��ʾ(����)������ͼʾ����SO32-�ĵ�һ��ˮ��ƽ�ⳣ��=____��