题目内容
10.碱式氧化镍(NiOOH)可用作镍氢电池的正极材料.以含镍(Ni2+)废液为原料生产NiOOH的一种工艺流程如下:
(1)加入Na2CO3溶液时,确认Ni2+已经完全沉淀的实验方法是静置,在上层清液中继续滴加1~2滴Na2CO3溶液,无沉淀生成.
(2)已知Ksp[Ni(OH)2]=2×10-15,欲使NiSO4溶液中残留c(Ni2+)≤2×10-5 mol•L-1,调节pH的范围是pH≥9.
(3)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式:4Ni(OH)2+O2$\frac{\underline{\;\;△\;\;}}{\;}$4NiOOH+2H2O.
(4)若加热不充分,制得的NiOOH中会混有Ni(OH)2,其组成可表示为xNiOOH•yNi(OH)2.现称取9.18g样品溶于稀硫酸,加入100mL 1.0mol•L-1 Fe2+标准溶液,搅拌至溶液清亮,定容至200mL.取出20.00mL,用0.010mol•L-1 KMnO4标准溶液滴定,用去KMnO4标准溶液20.00mL,试通过计算确定x、y的值(写出计算过程).涉及反应如下(均未配平):NiOOH+Fe2++H+-Ni2++Fe3++H2O Fe2++MnO4-+H+-Fe3++Mn2++H2O.
分析 含镍(Ni2+)废液为原料生产NiOOH,在含Ni+的废液中中加入碳酸钠溶液,过滤得到NiCO3沉淀,沉淀中加入硫酸溶解生成NiSO4,加入试剂调节溶液的pH使镍离子全部沉淀生成Ni(OH)2,在空气中加热Ni(OH)2制取NiOOH;
(1)确认Ni2+已经完全沉淀的实验方法是取上层清液,加入碳酸钠溶液观察是否有沉淀生成,判断镍离子是否全部沉淀;
(2)依据溶度积常数计算溶液中氢氧根离子浓度,结合离子积常数计算溶液中的氢离子浓度,pH=-lgc(H+);
(3)空气中加热Ni(OH)2和空气中氧气反应生成NiOOH和水;
(4)消耗KMnO4物质的量:0.01 mol•L-1×0.02L=2×10-4 mol,
与NiOOH反应后剩余的Fe2+物质的量:2×10-4 mol×5×(200÷20)=0.01 mol
Fe2+总物质的量:1.0 mol•L-1×0.1 L=0.1 mol
与NiOOH反应的Fe2+的物质的量:0.1 mol-0.01 mol=0.09 mol
得到n(NiOOH)=0.09 mol,计算得到NiOOH的质量,得到混合物中Ni(OH)2的质量,计算物质的量,依据xNiOOH•yNi(OH)2计算x和y的比值.
解答 解:(1)确认Ni2+已经完全沉淀的实验方法是取上层清液,加入碳酸钠溶液观察是否有沉淀生成,判断镍离子是否全部沉淀,具体操作步骤为:静置,在上层清液中继续滴加1~2滴Na2CO3溶液,无沉淀生成;
故答案为:静置,在上层清液中继续滴加1~2滴Na2CO3溶液,无沉淀生成;
(2)已知Ksp[Ni(OH)2]=2×10-15,欲使NiSO4溶液中残留c(Ni2+)≤2×10-5 mol•L-1,
Ksp[Ni(OH)2]=c(Ni2+)×c2(OH-)=2×10-15,c(OH-)=$\sqrt{\frac{2×1{0}^{-15}}{2×10{\;}^{-5}}}$=10-5mol/L,c(H+)=$\frac{10{\;}^{-14}}{10{\;}^{-5}}$=10-9mol/L,pH=9;
c(Ni2+)≤2×10-5 mol•L-1,调节pH的范围是pH≥9;
故答案为:pH≥9;
(3)空气中加热Ni(OH)2和空气中氧气反应生成NiOOH和水,原子守恒配平书写化学方程式为:4Ni(OH)2+O2$\frac{\underline{\;\;△\;\;}}{\;}$4NiOOH+2H2O,
故答案为:4Ni(OH)2+O2$\frac{\underline{\;\;△\;\;}}{\;}$4NiOOH+2H2O;
(4)消耗KMnO4物质的量:0.01 mol•L-1×0.02L=2×10-4 mol
与NiOOH反应后剩余的Fe2+物质的量:2×10-4 mol×5×(200÷20)=0.01 mol
Fe2+总物质的量:1.0 mol•L-1×0.1 L=0.1 mol
与NiOOH反应的Fe2+的物质的量:0.1 mol-0.01 mol=0.09 mol
n(NiOOH)=0.09 mol
m(NiOOH)=91.7 g•mol-1×0.09 mol=8.253 g
n[Ni(OH)2]=$\frac{9.18g-8.253g}{92.7g•mo{l}^{-1}}$=0.01 mol
x:y=n(NiOOH):n[Ni(OH)2]=0.09 mol:0.01 mol=9:1,
即x=9、y=1,
答:x、y的值分别为9,1.
点评 本题考查了物质分离方法和实验过程分析判断,溶度积常数和离子积常数的计算应用,注意流程的理解应用,掌握实验基础和物质性质是关键,题目难度中等.

| A. | C4H10 | B. | C3H6O | C. | CH4O | D. | C2H4Cl2 |
| A. | 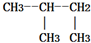 与 与 | B. | CH2=CH2与CH-CH3 | ||
| C. | 氢H和重氢D(${\;}_{1}^{1}$H与${\;}_{1}^{2}$H) | D. | 氧气与臭氧(O3) |
| A. | 检验亚硫酸钠试样是否变质:试样$\stackrel{溶解}{→}$滴加$\stackrel{硝酸钡溶液}{→}$白色沉淀滴加$\stackrel{稀盐酸}{→}$沉淀不溶解-→说明试样已变质 | |
| B. | 除去粗盐中硫酸钙杂质:粗盐$\stackrel{溶解}{→}$足量$\stackrel{碳酸钠溶液}{→}$足量$\stackrel{氯化钡}{→}$溶液$\stackrel{过滤}{→}$滤液中$\stackrel{滴加}{→}$盐酸$\stackrel{结晶}{→}$精盐 | |
| C. | 检验某溶液中是否含有Fe2+试样$\stackrel{KSCN溶液}{→}$溶液颜色无变化$\stackrel{滴加氨水}{→}$溶液变红色-→溶液中含有Fe2+ | |
| D. | 证明酸性条件H2O2的氧化性比I2强:NaI溶液30%$\stackrel{H_{2}O_{2}}{→}$稀硝酸$\stackrel{淀粉}{→}$溶液变蓝色-→氧化性:H2O2>I2 |
| A. | Fe3+、Cl-、Na+ | B. | Ba2+、Mg2+、CO32- | C. | Na+、K+、CO32- | D. | NO3-、Al3+、OH- |
| A. | 石油的裂化 | B. | 石油裂解 | C. | 石油的分馏 | D. | 古代植物变成煤 |
| A. | 等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH-+2HCO3-═BaCO3↓+CO32-+2H2O | |
| B. | 用 CH3COOH 溶解 CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 甲烷与氯气光照生成一氯甲烷:CH4+Cl2→CH3Cl+H++Cl- | |
| D. | 铜溶解于氯化铁溶液中:2Fe3++Cu═2Fe2++Cu2+ |

实验方法:在干燥的锥形瓶中放入称量好的水杨酸(6.2g 0.045mol)、乙酸酐(5mL 5.4g 0.053mol),滴入5滴浓硫酸,在70℃反应一段时间,按如下流程分离出乙酰水杨酸.
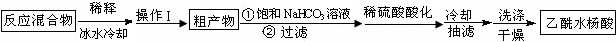
已知:①乙酰水杨酸溶于热水,在冷水中微溶;乙酸酐遇水生成乙酸.饱和NaHCO3溶液
②乙酰水杨酸钡、水杨酸钡均可溶于水.
(1)反应后用40mL冰水稀释反应混合物的操作是:待反应液稍冷后,在玻璃棒不断搅拌下将反应液沿烧杯壁慢慢倒入40ml冰水中.
(2)操作Ⅰ为过滤.
(3)判断粗产物与饱和碳酸氢钠反应完全的现象是:无气泡产生.
(4)某同学推测产品中可能还含有少量水杨酸和Na2SO4,设计了如下方案进行检验,实验证明不含杂质,请在答题卡上完成表中内容.
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将少量产品加入6mL水的试管A中,振荡,将上层液体倾析至B、C中. | 得到白色晶体和无色溶液 | |
| ② | 向试管B中,加入少量BaCl2溶液(或取试管B中溶液做焰色反应实验). 此空删去.此空删去 | 无白色沉淀生成 | 产品中不含SO42- |
| ③ | 向试管C中,加入少量FeCl3溶液(或浓溴水). 此空删去.此空删去 | 溶液不显紫色(或无白色沉淀出现). | 产品中不含水杨酸 |
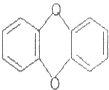
| A. | 高分子化合物 | B. | 芳香烃 | C. | 烃 | D. | 有机物 |