题目内容
【题目】高纯度氧化铝有广泛的用途,某研究小组用以下流程制取高纯度氧化铝:
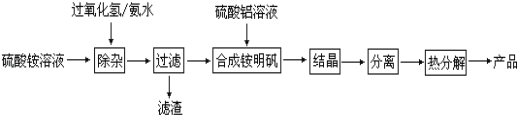
根据上述流程图填空:
(1)“除杂”操作是先加入过氧化氢充分反应后,再用氨水调节溶液的pH,使硫酸铵溶液中的少量Fe2+氧化为Fe3+并进一步转化为Fe(OH)3从而除去Fe2+,则Fe2+酸性条件下氧化为Fe3+的离子方程式为:
(2)配制硫酸铝溶液时,需用硫酸酸化,酸化的目的是 。
(3)“分离”操作的名称是 (填字母代号)。
A.蒸馏 B.分液 C.过滤
(4)铵明矾晶体的化学式为NH4Al(SO4)212H2O,铵明矾属于 (填“纯净物”或“混合物”)在0.1mol/L铵明矾的水溶液中,浓度最大的离子是 。
(5)热分解中发生如下反应6NH4Al(SO4)2 = 3Al2O3 + 2NH3 ↑+ 2N2 ↑+ 6SO2 ↑+ 6SO3 ↑+ 9H2O,当生成1mol Al2O3时转移电子物质的量为 mol
(6)往含0.1mol铵明矾稀溶液中逐滴加入含0.3mol Ba(OH)2的稀溶液,反应的总离子方程式为: 。
【答案】(1)2Fe2+ + H2O2 + 2H+ == 2Fe3+ + 2H2O
(2)抑制Al3+水解(填防止水解不给分)
(3)C (4)纯净物,SO42-(5)4
(6)NH4++Al3++2SO42-+2Ba2++5OH-==NH3·H2O+AlO2-+2BaSO4↓+2H2O
【解析】
试题分析:(1)H2O2溶液具有强氧化性,可以氧化亚铁离子生成铁离子,反应的离子方程式:2Fe2+ + H2O2 + 2H+ == 2Fe3+ + 2H2O。
(2)由于铝离子在溶液中能够发生水解生成氢氧化铝,所以加入硫酸酸化,抑制铝离子的水解。
(3)把晶体从混合物中“分离”操作的名称是过滤,答案选C。
(4)铵明矾晶体的化学式为NH4Al(SO4)212H2O,铵明矾有固定的组成,属于纯净物;在0.1mol/L铵明矾的水溶液中,未水解前,c(Al3+)=c(NH4+)=0.1mol/L,由于铵根和铝离子均水解,水解结合水电离出的氢氧根,水解后浓度均小于0.1mol/L,c(SO42-)=0.2mol/L,所以在0.1mol/L铵明矾的水溶液中,浓度最大的离子是SO42-。
(5)该反应中N元素化合价由-3价变为0价、S元素化合价由+6价变为+4价, 6NH4Al(SO4)2 = 3Al2O3 + 2NH3 ↑+ 2N2 ↑+ 6SO2 ↑+ 6SO3 ↑+ 9H2O,转移12e-,所以当生成1mol Al2O3时转移电子物质的量为4mol。
(6)往含0.1mol铵明矾(NH4Al(SO4)212H2O)稀溶液中逐滴加入含0.3mol Ba(OH)2的稀溶液,OH-先与Al3+反应,1molAl3+消耗3molOH-,然后NH4+与OH-反应生成氨气和水,1mol铵根离子消耗1mol氢氧根离子,氢氧化铝溶解需要1molOH-,一共消耗5molOH-,同时2mol硫酸根离子消耗2mol钡离子生成硫酸钡沉淀,反应的总离子方程式为NH4++Al3++2SO42- + 2Ba2+ +5OH- = NH3·H2O + AlO2-+2BaSO4↓+2H2O。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】如图是周期表中短周期的一部分,已知A、C两种元素的核电荷数之和等于B的核电荷数,下列叙述正确的是( )
A | C | |
B |
A.B为第二周期的元素
B.C为第五主族元素
C.A的原子序数为6
D.C是非金属性最强的元素