题目内容
【题目】向一定量的盐酸中逐滴加入NaAlO2溶液,生成沉淀Al(OH)3的量随NaAlO2加入量的变化关系如图所示。生成的沉淀过滤除去后,则下列离子组在对应的溶液中一定能大量共存的是
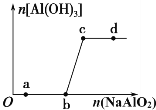
A. a点对应的溶液中:Na+、K+ HCO3- Cl-
B. b点对应的溶液中:Na+、OH-、SO42-、Cl-
C. c点对应的溶液中:Na+、K+、Ag+、NO3-
D. d点对应的溶液中:Na+、K+、OH-、Cl-
【答案】D
【解析】
由题中图象可判断,向一定量的盐酸中逐滴加入NaAlO2溶液时,依次发生的化学反应。进而根据所得溶液的成分,判断所给离子组能否大量存在。
向一定量盐酸中逐滴加入NaAlO2溶液时,Ob段反应为NaAlO2+4HCl=NaCl+AlCl3+2H2O,bc段反应为AlCl3+3NaAlO2+6H2O=4Al(OH)3↓+3NaCl,c点后加入的NaAlO2不反应。
A项:a点对应的溶液中有生成的NaCl、AlCl3和剩余的HCl, HCO3-与H+反应而不能大量存在,A项不符合题意;
B项:b点恰好反应,溶液中溶质只有生成的NaCl、AlCl3,因OH-能与Al3+反应而不能大量存在,B项不符合题意;
C项:c点两个反应依次进行完全,滤液中溶质只有NaCl,因Ag+与Cl-生成沉淀而不能大量存在,C项不符合题意;
D项:d点对应的滤液中有生成的NaCl和过量的NaAlO2,与Na+、K+、OH-、Cl-都能大量共存,D项符合题意。
本题选D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目