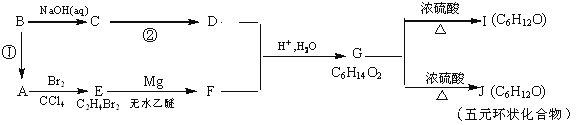
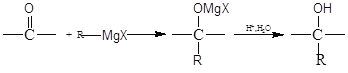题目内容
【题目】在如图中,甲烧杯中盛有100 mL 0.50 molL-1 AgNO3溶液,乙烧杯中盛有100 mL 0.25 molL-1 CuCl2溶液,A、B、C、D均为质量相同的石墨电极,如果电解一段时间后,发现A极比C极重1.9 g,则

(1)电源E为________极。
(2)A极析出物质______ mol。
(3)B极的电极反应式为____________________。
(4)C极的电极反应式为_____________________。
(5)D极析出气体________ mL(标准状况)。
【答案】 负 0.025 2H2O —2e—=== O2↑+ 4H+ Cu2++ 2e—= Cu 280
【解析】由题中信息可知,甲烧杯中盛有100 mL 0.50 molL-1 AgNO3溶液,乙烧杯中盛有100 mL 0.25 molL-1 CuCl2溶液,A、B、C、D均为质量相同的石墨电极,如果电解一段时间后,发现A极比C极重1.9 g,则A、C为阴极,B、D为阳极,E为负极、F为正极。甲、乙两池为串联的电解池。
(1)电源E为负极。
(2)A极析出物质是Ag,C极析出的是Cu,根据电子转移守恒可知,每析出1molAg,同时就析出0.5molCu,两电极的质量相差108g-32g=76g,所以,当A极比C极重1.9 g时,A极析出Ag的物质的量为![]() 0.025mol。
0.025mol。
(3)B极上水电离的氢氧根离子放电生成氧气,其电极反应式为2H2O —2e—=== O2↑+ 4H+。
(4)C极上溶液中的铜离子放电,其电极反应式为Cu2++ 2e—= Cu。
(5)D极上氯离子放电生成氯气,由电子转移守恒可知析出0.0125molCl2,在标准状况下其体积为280mL。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案【题目】某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000 molL-1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂刚好变色,且半分钟不变色,测得所耗盐酸的体积为V1mL。
④重复以上过程两次,但在重复第一次时滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。
试回答下列问题:
(1)锥形瓶中的溶液从 _________色变为______ 色时,停止滴定。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察 ____________
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是 ______________________,由此造成的测定结果 _________________(偏高、偏低或无影响)
(4)步骤②缺少的操作是 ________________________________
(5)下图,是某次滴定时的滴定管中的液面,其读数为 _____________mL

(6)V1 ______ V2 (填大于、小于、或等于)
(7)纠正错误以后实验测出下列数据:
滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 25.00 | 0.50 | 20.40 |
第二次 | 25.00 | 4.00 | 24.10 |
第三次 | 25.00 | 0.50 | 23.40 |
请计算待测烧碱溶液的浓度:____________________ molL-1