题目内容
将几滴KSCN(SCN-是“类卤离子”,与氯离子性质相似)溶液加入酸性的含有Fe3+的溶液中,溶液变成血红色。将该红色溶液分为两份,①一份中加入适量KMnO4溶液,红色褪去;②向另一份中通入SO2,红色也褪去。
下列说法不正确的是
下列说法不正确的是
| A.①红色褪去的原因可能是KMnO4将SCN-氧化,使[Fe(SCN)]2+消失 |
| B.[Fe(SCN)]2+中Fe3+与SCN-以配位键结合。 |
| C.②红色褪去的原因是SO2具有漂白性 |
| D.SCN-在适当条件下可失去电子被氧化剂氧化为(SCN)2 |
C
试题分析:A.①在溶液中存在平衡:Fe3++3SCN-
 Fe(SCN)3. KMnO4有强氧化性,当滴入KMnO4溶液时,KMnO4将SCN-氧化为(SCN)2,平衡逆向移动,红色物质逐渐减少,因此红色褪去。正确。B.在Fe3+中存在空轨道,在SCN-的S原子上存在孤对电子,所以[Fe(SCN)]2+中Fe3+与SCN-以配位键结合。正确。C.②红色褪去的原因是因为发生反应:SO2+2Fe3++2H2O=2Fe2++4H++SO42-.错误。D.SCN-有还原性,在适当条件下当遇到强氧化剂时可失去电子被氧化剂氧化为(SCN)2。正确。
Fe(SCN)3. KMnO4有强氧化性,当滴入KMnO4溶液时,KMnO4将SCN-氧化为(SCN)2,平衡逆向移动,红色物质逐渐减少,因此红色褪去。正确。B.在Fe3+中存在空轨道,在SCN-的S原子上存在孤对电子,所以[Fe(SCN)]2+中Fe3+与SCN-以配位键结合。正确。C.②红色褪去的原因是因为发生反应:SO2+2Fe3++2H2O=2Fe2++4H++SO42-.错误。D.SCN-有还原性,在适当条件下当遇到强氧化剂时可失去电子被氧化剂氧化为(SCN)2。正确。
练习册系列答案
 全程金卷系列答案
全程金卷系列答案 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
 2SO3(g) △H<0,下列研究目的和图示相符的是
2SO3(g) △H<0,下列研究目的和图示相符的是 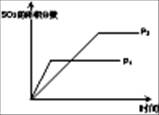

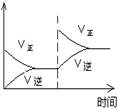
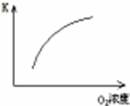
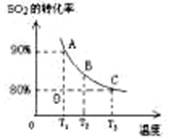
 C(g)+D(g),当混合气体的密度不再改变时,说明已达到化学平衡状态
C(g)+D(g),当混合气体的密度不再改变时,说明已达到化学平衡状态 增大
增大 不变
不变 2NH3一定处于平衡状态的是……… ( )
2NH3一定处于平衡状态的是……… ( ) SO3 △H <0,现将0.050mol SO2和0.030mol O2
SO3 △H <0,现将0.050mol SO2和0.030mol O2 CO2(g)+H2(g)ΔH<0。820 ℃时在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,达到平衡状态,K=1.0。
CO2(g)+H2(g)ΔH<0。820 ℃时在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,达到平衡状态,K=1.0。 NH3(g)+HI(g);
NH3(g)+HI(g);