题目内容
13.下列说法正确的是( )| A. | 氯化钠和盐酸溶于水都发生电离,克服粒子间作用力的类型相同 | |
| B. | 金刚石的网状结构中,由共价键形成的最小碳环上有6个碳原子 | |
| C. | HI的分子质量大于HF,所以HI的沸点高于HF | |
| D. | 由IA族和VIA族元素形成的原子个数比为l:1,离子个数比为2:l的化合物是含有共价键的离子化合物 |
分析 A.氯化钠中只含离子键、HCl中只含共价键;
B.金刚石的网状结构中,由共价键形成的最小碳环上有6个碳原子;
C.同一主族氢化物中,氢化物的熔沸点与相对分子质量成正比,但含有氢键的物质熔沸点最高;
D.由IA族和VIA族元素形成的原子个数比为l:1、离子个数比为2:l的化合物分别如:H2O2、Na2O或Na2O2,H2O2只含共价键、Na2O或Na2O2含离子键.
解答 解:A.氯化钠中只含离子键、HCl中只含共价键,所以NaCl、HCl分别溶于水时,前者破坏离子键、后者破坏共价键,故A错误
B.金刚石的结构为 ,由模型可知最小的环为六元环,故B正确;
,由模型可知最小的环为六元环,故B正确;
C.同一主族氢化物中,氢化物的熔沸点与相对分子质量成正比,但含有氢键的物质熔沸点最高,HF中含有氢键但HI中不含氢键,所以熔沸点HF>HI,故C错误;
D.由IA族和VIA族元素形成的原子个数比为l:1、离子个数比为2:l的化合物分别如:H2O2、Na2O或Na2O2,H2O2只含共价键、Na2O或Na2O2含离子键,双氧水是共价化合物、氧化钠或过氧化钠都是离子化合物,故D错误;
故选B.
点评 本题考查物质结构与性质、化学键等知识点,明确物质的构成微粒、分子晶体熔沸点比较方法等是解本题关键,采用举例法分析解答,易错选项是A.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比为7:17;X、W同主族;Y的原子序数是W和X的原子序数之和的一半;含Z元素的物质焰色反应为黄色.下列判断正确的是( )
| A. | 离子的氧化性:Y>Z | B. | 氢化物的沸点:X<W | ||
| C. | X、W最高正价相同 | D. | 原子及离子半径:Z>Y>X |
18.下列化合物的1H-NMR谱图中吸收峰的数目不正确的是( )
| A. | 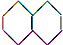 (2组) | B. | 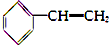 (5组) | C. | 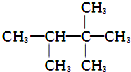 (3组) (3组) | D. | 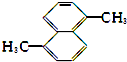 (4组) (4组) |
5.下列有关碱金属的说法中,不正确的是( )
| A. | IA族元素都是碱金属元素 | B. | K的还原性强于Na | ||
| C. | Na和Na+灼烧时都能使火焰呈黄色 | D. | Na在空气中燃烧时生成Na2O2 |
2.NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 常温常压下,30克乙酸与30克葡萄糖含有的氧原子数均为NA | |
| B. | 在标准状况下,11.2L O2和22.4 L NO混合并充分反应后得到的气体分子数为NA | |
| C. | 3.65克液态HCl中含有构成粒子的总数为0.2NA | |
| D. | 常温下,5.6克Fe投入到足量浓硝酸中,转移电子数为0.3NA |
3.下列叙述,错误的是( )
| A. | 化学电源均是根据原电池的工作原理设计的 | |
| B. | 反应A+B=C+D为吸热反应,则A的能量高于物质具有的能量 | |
| C. | 石墨转化为金刚石时要吸热,则说明石墨比金刚石稳定 | |
| D. | 燃料电池是一种高效、环保的新型化学电源 |
 实验室制硝基苯的装置见如图
实验室制硝基苯的装置见如图 .
.