题目内容
8.(1)若有机化合物只含C、H元素,120℃下,在足量的氧气中充分燃烧生成CO2、H2O,并恢复原来温度,燃烧前后的气体的物质的量相等,①写出符合上述条件的最简单有机物的分子式CH4.
②若分子中所有原子共平面,写出符合上述条件有机物的结构简式CH2=CH2.
(2)若有机化合物含C、H、O元素,在室温下,在足量的氧气中充分燃烧生成CO2、H2O,并恢复到室温,其燃烧所消耗O2的物质的量与燃烧后所产生的气体的物质的量相等.
①写出符合上述条件的有机物的通式Cn(H2O)m.
②若分子中含二个碳原子,且能与NaOH溶液反应,写出符合上述条件的一个有机物的结构简式CH3COOH或HCOOCH3.
分析 (1)令有机物组成为CxHy,完全燃烧方程式为:CxHy+(x+$\frac{y}{4}$)O2$\frac{\underline{\;点燃\;}}{\;}$xCO2+$\frac{y}{2}$H2O(g),恢复原来温度,燃烧前后的气体的物质的量相等,则1+x+$\frac{y}{4}$=x+$\frac{y}{2}$,则y=4.
①符合上述条件的最简单有机物为甲烷;
②若分子中所有原子共平面,符合上述条件有机物为乙烯;
(2)①令有机物组成为CxHyOz,完全燃烧方程式为:CxHyOz+(x+$\frac{y}{4}$-$\frac{z}{2}$)O2$\frac{\underline{\;点燃\;}}{\;}$xCO2+$\frac{y}{2}$H2O(l),恢复原来温度,其燃烧所消耗O2的物质的量与燃烧后所产生的气体的物质的量相等,则x+$\frac{y}{4}$-$\frac{z}{2}$=x,故y=2z,有机物的组成为Cn(H2O)m;
②若分子中含二个碳原子,且能与NaOH溶液反应,含有羧基或酯基,结合组成通式书写.
解答 解:(1)令有机物组成为CxHy,完全燃烧方程式为:CxHy+(x+$\frac{y}{4}$)O2$\frac{\underline{\;点燃\;}}{\;}$xCO2+$\frac{y}{2}$H2O(g),恢复原来温度,燃烧前后的气体的物质的量相等,则1+x+$\frac{y}{4}$=x+$\frac{y}{2}$,则y=4.
①符合上述条件的最简单有机物为CH4,故答案为:CH4;
②若分子中所有原子共平面,符合上述条件有机物为CH2=CH2,故答案为:CH2=CH2;
(2)①令有机物组成为CxHyOz,完全燃烧方程式为:CxHyOz+(x+$\frac{y}{4}$-$\frac{z}{2}$)O2$\frac{\underline{\;点燃\;}}{\;}$xCO2+$\frac{y}{2}$H2O(l),恢复原来温度,其燃烧所消耗O2的物质的量与燃烧后所产生的气体的物质的量相等,则x+$\frac{y}{4}$-$\frac{z}{2}$=x,故y=2z,有机物的组成为Cn(H2O)m,故答案为:Cn(H2O)m;
②若分子中含二个碳原子,且能与NaOH溶液反应,该有机物为CH3COOH或HCOOCH3,故答案为:CH3COOH或HCOOCH3.
点评 本题考查有机物燃烧有关计算、有机物结构的确定,注意利用组成通式进行分析解答,难度中等.

 华东师大版一课一练系列答案
华东师大版一课一练系列答案 .则下列说法正确的是( )
.则下列说法正确的是( )| A. | 3p能级上的电子数只能为6 | |
| B. | 3d能级上的电子数可能为1-10 | |
| C. | Y可只能为3-8 | |
| D. | 2p,3p能级上的电子数可以相同,也可以不同 |

(1)如何检查该装置的气密性:将C处导气管末端浸入水槽中,加热A处圆底烧瓶,导管末端出现气泡,停止加热后导管末端出现一段水柱
(2)写出铁与水蒸气反应的化学方程式3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2
(3)验证固体产物中铁元素的价态
限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹;1mol/L CuSO4、3mol/L H2SO4、3mol/L HNO3、30%H2O2、0.01mol/L KMnO4、20%KSCN、蒸馏水.
在答题卡上按下表的格式写出实验步骤、预期现象与结论.
| 实验步骤 | 预期现象与结论 | |
| 步骤1 | 取反应后干燥的固体ag于试管中,加入足量的1mol/L CuSO4溶液,充分振荡,经固液分离、洗涤后,再向固体中滴加足量的3mol/LH2SO4,振荡溶解,过滤后将滤液配成250mL溶液,待用. | - |
| 步骤2 | 取少量步骤1中滤液于试管中,滴加1~2滴20%KSCN | 溶液变红色,则固体产物含+3价铁 |
| 步骤3 | 取少量步骤1中滤液于试管中,滴加1~2滴0.01mol/LKMnO4 | 溶液紫色褪去,则固体产物含+2价铁 |
(4)固体产物中铁元素的质量分数的测定可采用图2的流程.其中步骤①是向溶液中加入锌粉至黄色刚好消失;步骤②用0.010mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液平均为v mL.(已知5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O)其中加入锌粉的目的是将Fe3+还原为Fe2+.实验测得ag样品中固体产物铁元素的质量分数为$\frac{250×5×56g/mol×0.010mol/L×V×1{0}^{-3}L}{25a}$×100%_(只列计算表达式).
| A. | 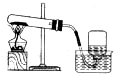 制取、收集O2 制取、收集O2 | B. | 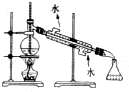 制无水乙醚 制无水乙醚 | ||
| C. | 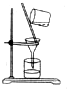 除去NaCl中的泥沙 除去NaCl中的泥沙 | D. | 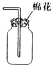 收集NO 收集NO |
| A. | 氯化钠和盐酸溶于水都发生电离,克服粒子间作用力的类型相同 | |
| B. | 金刚石的网状结构中,由共价键形成的最小碳环上有6个碳原子 | |
| C. | HI的分子质量大于HF,所以HI的沸点高于HF | |
| D. | 由IA族和VIA族元素形成的原子个数比为l:1,离子个数比为2:l的化合物是含有共价键的离子化合物 |
| A. | 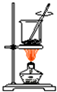 海带烧成灰 海带烧成灰 | |
| B. | 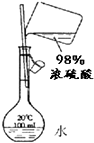 配制稀硫酸 配制稀硫酸 | |
| C. |  分离碘并回收苯 分离碘并回收苯 | |
| D. |  X为CCl4,可用于吸收HCl,并防止倒吸 X为CCl4,可用于吸收HCl,并防止倒吸 |
| A. | 燃烧不一定有氧气参加,也不一定是放热反应 | |
| B. | 火箭点火后,喷出的红色火焰是金属的焰色反应产生的 | |
| C. | 火箭燃料燃烧主要是将化学能转变为热能和光能,可能对环境产生污染 | |
| D. | 偏二甲肼燃烧的热化学方程式是:C2H8N2(g)+2N2O4(g)═2N2(g)+2CO2(g)+4H2O(g);△H=-2550kJ/mol |
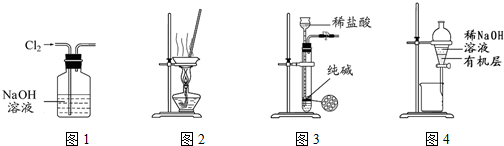
| A. | 用图1所示装置除去Cl2中含有的少量HCl | |
| B. | 用图2所示装置由MgCl2溶液制备无水MgCl2晶体 | |
| C. | 用图3所示装置制取少量CO2气体 | |
| D. | 用图4所示装置除去溴苯中混有的少量Br2 |