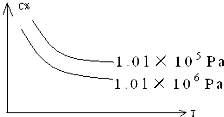题目内容
【题目】在25℃时,pH=12的NaOH溶液100mL,欲使它的pH降为11,需加入pH=10的NaOH溶液mL; 在25℃时,有pH为a的盐酸和pH为b的NaOH溶液等体积混合:若a+b=13,则溶液呈性;pH为2的盐酸和pH为12的NaOH溶液,由水电离的氢离子浓度之比为 .
【答案】1000;酸;1:1
【解析】解:在25℃时,pH=12的NaOH溶液中c(OH﹣)= ![]() mol/L=0.01mol/L,欲使它的pH降为11,pH=11的NaOH溶液中c(OH﹣)=
mol/L=0.01mol/L,欲使它的pH降为11,pH=11的NaOH溶液中c(OH﹣)= ![]() mol/L=0.001mol/L,pH=10的溶液中c(OH﹣)=
mol/L=0.001mol/L,pH=10的溶液中c(OH﹣)= ![]() mol/L=0.0001mol/L, 设加入pH=10的NaOH溶液体积为VL,
mol/L=0.0001mol/L, 设加入pH=10的NaOH溶液体积为VL,
c(OH﹣)= ![]() mol/L=0.001mol/L=
mol/L=0.001mol/L= ![]() ,
,
V=1,即1000mL;
在25℃时,有pH为a的盐酸溶液中c(H+)=10﹣a mol/L,pH为b的NaOH溶液中c(OH﹣)=10 b﹣14 mol/L,二者等体积混合,若a+b=13,c(OH﹣)=10 b﹣14 mol/L=10 b﹣(a+b+1) mol/L=10 ﹣(a+1) mol/L<10﹣a mol/L,二者等体积混合酸有剩余,溶液呈酸性;
酸或碱抑制水电离,pH为2的盐酸和pH为12的NaOH溶液中水电离出的c(H+)都为 ![]() mol/L=10﹣10 mol/L,所以二者电离出的氢离子浓度之比为1:1,
mol/L=10﹣10 mol/L,所以二者电离出的氢离子浓度之比为1:1,
所以答案是:1000;酸;1:1.

 阅读快车系列答案
阅读快车系列答案【题目】为测定碱式碳酸钴[COx(OH)y(CO3)z]的化学组成,研究性学习小组的同学设计了如图所示的装置进行实验探究.已知:碱式碳酸钴受热时可分解生成三种氧化物. 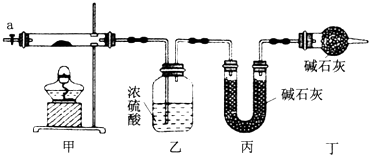
(1)按如图所示装置组装好仪器,并;称取3.65g样品置于硬质玻璃管内,加热,当乙装置中(填实验现象),停止加热;打开活塞a,缓缓通入空气数分钟,通入空气的目的是 .
(2)某同学认为上述实验中存在一个缺陷,该缺陷是 .
(3)通过正确实验测得乙、丙装置增重分别为0.36g、0.88g,则该碱式碳酸钴的化学式为 .
(4)CoCl26H2O常用作多彩水泥的添加剂.以含钴废料(含少量Fe、Al等杂质)制取COCl26H2O的一种工艺如下: 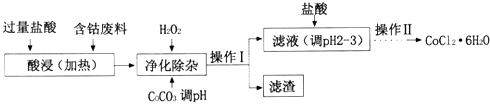
已知;25℃时
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
①净化除杂时,加入H2O2发生反应的离子方程式为;
②加入CoCO3调pH为5.2~7.6,则操作I获得的滤渣成分为;
③加盐酸调整pH为2~3的目的为;
④操作Ⅱ过程为蒸发浓缩、冷却结晶、过滤.
【题目】25℃时某些弱酸的电离平衡常数如下表所示:
CH3COOH | HClO | H2CO3 |
K(CH3COOH) | K(HClO) | K(H2CO3)a1=4.4×10﹣7 |
常温下,稀释CH3COOH、HClO两种酸时,溶液的pH随加水量变化的曲线如图所示,下列说法正确的是( )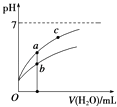
A.相同浓度的CH3COOH和HClO的混合溶液中,各离子浓度的大小关系是:c(H+)>c(ClO﹣)>c(CH3COO﹣)>c(OH﹣)
B.图象中a、c两点所处的溶液中 ![]() 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
C.图象中a点酸的浓度大于b点酸的浓度
D.向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO﹣+CO2+H2O=2HClO+CO32﹣