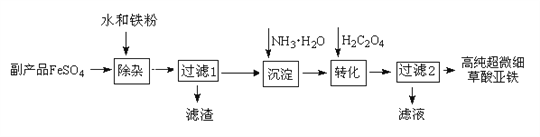
题目内容
【题目】铁元素与我们的生活息息相关。回答下列问题:
(1)硝普钠(Na2[Fe(CN)5(NO)] 2H2O)可用于治疗急性心率衰竭。
①Fe3+的价电子轨道表示式为____________。
②硝普钠中不存在的作用力有____________(填序号)。
a.离子键 b.金属键 c.配位键 d.极性共价键 e.非极性共价键 f.氢键
③硝普钠的内界[Fe(CN)5(NO)]2-中,非金属元素的第一电离能由大到小的顺序为______,由其中两种元素按原子个数比为1:3组成的常见阴离子的空间构型为_________。
(2)三氯化铁是一种重要的铁盐,熔沸点较低,易溶于丙酮。
①FeCl3晶体类型为____________。
②FeCl3的熔点(555K)高于AlCl3(467K)的原因是_______________。
③Fe3+可用KSCN溶液检验,SCN-中σ键和π键的个数比为_______。
(3)某FexNy的晶胞如下图1所示,其化学式为____________,Cu可完全替代该晶体中的A位置Fe或B位置Fe,形成产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如下图2所示。其中更稳定的Cu替代型产物晶体的密度为ρ gcm-3,阿伏加德罗常数为NA,求晶胞参数a=___nm。

【答案】![]() b、e N>O>C 平面三角形 分子晶体 二者均为分子晶体,且组成和结构相似,FeCl3的相对分子质量大,分子间作用力(或范德华力)大 1:1 Fe4N
b、e N>O>C 平面三角形 分子晶体 二者均为分子晶体,且组成和结构相似,FeCl3的相对分子质量大,分子间作用力(或范德华力)大 1:1 Fe4N 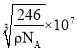
【解析】
(1)①Fe的原子序数为26,依据基态原子的价层电子排布式书写Fe3+的价电子轨道表示式;
②根据络合物中存在的作用力判断;
③依据第一电离能的规律作答;根据价层电子对互斥理论分析空间构型;
(2)①根据给定的物理性质分析晶体类型;
②分子晶体的相对分子质量越大,分子间作用力(或范德华力)大;
③1个共价单键中含1个σ键,一个共价双键中含1个σ键和1个π键,再结合SCN-内化学键类型分析;
(3)利用“均摊法”计算出晶胞内Fe和N的个数,进而求出化学式;
由图2可知,Cu替代A位置的Fe时能量较低,更稳定,则Cu位于顶点,均摊法确定化学式,晶胞质量除以晶胞的体积得密度;
(1)①Fe原子的核外电子数为26,基态原子的价层电子排布式为3d64s2,失去3个电子得到Fe3+,则其价电子轨道表示式为![]() ;
;
②硝普钠(Na2[Fe(CN)5(NO)] 2H2O)中存在离子键、配位键、极性共价键和氢键,不存在金属键和非极性共价键,故答案选b、e;
③硝普钠的内界[Fe(CN)5(NO)]2-中,非金属元素为C、N和O,同周期元素的第一电离能呈增大趋势,但N元素的最高能级2p能级上为半充满结构,处于稳定状态,其第一电离能比O的大,因此第一电离能由大到小的顺序为N>O>C;C、N、O中两种元素按原子个数比为1:3组成的常见阴离子有CO32-、NO3-,CO32-、NO3-中中心原子的价层电子对数都为3,且中心原子上没有孤电子对,所以CO32-、NO3-的空间构型都为平面三角形;
(2)①三氯化铁是一种重要的铁盐,熔沸点较低,易溶于丙酮,属于分子晶体的物理特点,因此其晶体类型为分子晶体;
②FeCl3和AlCl3均为分子晶体,之所以FeCl3的熔点高,是因为二者组成和结构相似,FeCl3的相对分子质量大,分子间作用力(或范德华力)大;
③SCN-与CO2互为等电子体,CO2的结构式为O=C=O,1个CO2分子中含2个σ键和2个π键,因此SCN-中σ键和π键的个数比为1:1;
(3)根据图1可知,Fe在晶胞中的个数为:8×1/8+6×1/2=4,N位于体心,则只有1个N,则化学式为:Fe4N;由图2可知,Cu替代A位置的Fe时能量较低,更稳定,则Cu位于顶点,原子个数为8×1/8=1,Fe位于面心,原子个数为6×1/2=3,N位于体心,则只有1个N,其化学式为Fe3CuN,则晶胞的质量为![]() =
=![]() g,设晶胞的参数为anm,根据晶体密度ρg/cm3=
g,设晶胞的参数为anm,根据晶体密度ρg/cm3=![]() =
= 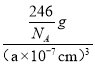 ,解得a=
,解得a=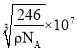 ,故答案为:Fe4N;
,故答案为:Fe4N;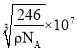 。
。