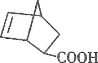
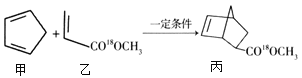题目内容
【题目】可逆反应A(g)+3B(g) ![]() 2C(g)+D(g) 在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
2C(g)+D(g) 在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
A.VA=0.15mol(Lmin)﹣1 B.VB=0.6 mol(Lmin)﹣1
C.VC=0.4 mol(Lmin)﹣1 D.VD=0.01 mol(Ls)﹣1
【答案】D
【解析】
试题分析:不同物质表示的速率之比等于其化学计量数之比,故反应速率与其化学计量数的比值越大,反应速率越快。A.![]() =0.15mol(Lmin)-1;B.
=0.15mol(Lmin)-1;B. ![]() =0.2mol(Lmin)-1;C.
=0.2mol(Lmin)-1;C. ![]() =0.2mol(Lmin)-1;D.VD=0.01 mol(Ls)-1=0.6mol(Lmin)-1,
=0.2mol(Lmin)-1;D.VD=0.01 mol(Ls)-1=0.6mol(Lmin)-1,![]() =0.6mol(Lmin)-1,故反应速率VD>VB=VC>VA,故选D。
=0.6mol(Lmin)-1,故反应速率VD>VB=VC>VA,故选D。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】铈(Ce)是一种重要的稀土元素。以富含CeO2的废玻璃粉末(含SiO2、 Fe2O3以及其他少量可溶于稀酸的杂质)为原料,采用多种方法回收铈。请回答下列问题:
(1)湿法空气氧化法回收铈的部分流程如下:

已知:CeO2不溶于稀盐酸,也不溶于NaOH溶液。
滤渣的成分是________,反应②的离子方程式是________。
(2)干法空气氧化法回收铈是把Ce(OH)3被空气氧化成Ce(OH)4,氧化过程中发生的化学反应方程式为________。两种制备Ge(OH)4的数据如下表:
干法空气氧化法 | 氧化温度/℃ | 氧化率/% | 氧化时间/h |
暴露空气中 | 110120 | 90 | 18 |
在对流空气氧化炉中 | 110120 | 99 | 8 |
在对流空气氧化炉中大大缩短氧化时间的原因是________。
(3)利用电解方法也可以实现铈的回收。
①在酸性条件下电解Ce2O3 (如图):阳极电极反应式为______,离子交换膜为______ (填“阴”或“阳”)离子交换膜。
②电解产物Ce(SO4)2是重要的氧化剂,将其配成标准溶液,在酸性条件下能测定工业盐中NaNO2的含量,写出发生反应的离子方程式_______。