题目内容
(10分)如图所示3套实验装置,分别回答下列问题。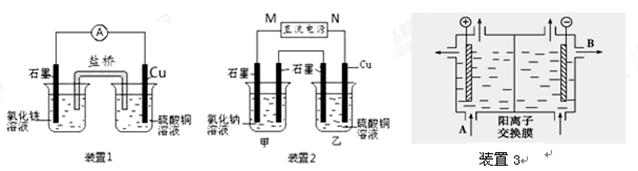
(1)装置1中的Cu是 极(填“正”或“负”),该装置发生的总反应的离子方程式为 。
(2)装置2中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到右边石墨电极附近首先变红,左边石墨电极附近无明显现象。
① 电源的M端为 极
② 乙烧杯中电解反应的离子方程式 。
(3)可用阳离子交换膜法电解饱和食盐水制NaOH,其工作原理装置3所示。
①请写出A、B两处物质的名称:A___________________B____________________
②请写出电解食盐水的离子方程式__________________________________________
(1)负 2Fe3+ + Cu = 2Fe2+ + Cu2+
(2) ①正
②2Cu2+ + 2H2O  2Cu + O2 ↑ + 4H+
2Cu + O2 ↑ + 4H+
(3) ① A: 饱和NaCl溶液; B :稀NaOH溶液
② 2Cl- + 2H2O  Cl2 ↑+ H2 ↑+ 2OH-
Cl2 ↑+ H2 ↑+ 2OH-
解析试题分析:⑴装置1为原电池,铜为负极,被氧化,石墨正极,其电池总反应为2Fe3++Cu═2Fe2++Cu2+;
⑵向甲烧杯中滴入几滴酚酞,观察到右边石墨电极附近首先变红,说明甲中右边电极反应生成OH-,该极应为电解池的阴极,则M为电源的正极,N为电源的负极,由此可知甲为电解食盐水装置,而乙为电解硫酸铜溶液的装置,其阳极生成氧气,阴极生成铜,则电解的离子方程式为2Cu2++2H2O 2Cu+O2↑+4H+;
2Cu+O2↑+4H+;
⑶根据电解池中阴离子移向阳极,阳离子移向阴极,图示装置中的交换膜是阳离子交换膜,A出口主要是饱和NaCl溶液,B出口主要是氢氧化钠溶液,甲装置是电解饱和食盐水,电解氯化钠溶液时生成氢氧化钠和氢气、氯气,其电解反应的离子方程式为:2Cl-+2H2O Cl2↑+H2↑+2OH-。
Cl2↑+H2↑+2OH-。
考点:考查电化学原理。

用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入 0.1molCu(OH)2后恰好恢复到电解前的浓度和PH。则电解过程中转移的电子数为( )
| A.0.1mol | B.0.2mol | C.0.3mol | D.0.4mol |
如图装置,U型管中盛有Fe(OH)3胶体,以两个碳棒为电极进行电解,一段时间后,下列叙述正确的是
| A.x是阳极,y是阴极 |
| B.x极附近颜色变深,y极近颜色变浅 |
| C.x是阴极,y极附近颜色加深 |
| D.y是阴极,x极附近颜色加深 |
(15分)制烧碱所用盐水需两次精制。第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、Fe3+、SO42-等离子,过程如下:
Ⅰ.向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ.向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ.滤液用盐酸调节pH,获得一次精制盐水。
(1)过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20℃/g)如下表:
| CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
②过程Ⅰ选用BaCl2而不选用CaCl2,运用表中数据解释原因____________________。
③除去Mg2+的离子方程式是_______________________________。
④检测Ca2+、Mg2+、Ba2+是否除尽时,只需检测_______(填离子符号)。
(2)第二次精制要除去微量的I-、IO3-、NH4+、Ca2+、Mg2+,流程示意如下:

①过程Ⅳ除去的离子是________________。
②盐水b中含有SO42-。Na2S2O3将IO3-还原为I2的离子方程式是________________。
③过程VI中,在电解槽的阴极区生成NaOH,结合化学平衡原理解释:___________。