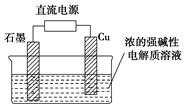
题目内容
原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)现有如下两个反应:A.NaOH+HCl=NaCl+H2O;B.Zn+H2SO4=ZnSO4+H2↑
判断能否设计成原电池A. ,B. 。(填“能”或“不能”)
(2)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题: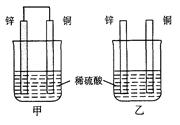
①下列说法正确的是 。
A.甲、乙均为化学能转变为电能的装置
B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少
D.两烧杯中溶液的pH均增大
②在相同时间内,两烧杯中产生气泡的速度:甲 乙(填“>”、“<“或“=” )
③请写出图中构成原电池的负极电极反应式 。
④当乙中产生1.12L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol·L-1(设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为 。
(3)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,氢气为燃料,采用氢氧化钠溶液为电解液;则氢气应通入 极(填a或b,下同),电子从 极流出。
(1)不能 能
(2)①BD ②> ③Zn - 2e- = Zn2+ ④1mol·L-1
(3)b b
解析试题分析:(1)A属于复分解反应,不是氧化还原反应,所以不能设计成原电池;B是置换反应,是氧化还原反应,能设计成原电池。(2)①A.甲具备原电池形成的条件,能把化学能转变为电能,而乙不具备原电池形成的条件,不能把化学能转变为电能。错误。B。由于活动性Cu<H,所以Cu不能把酸中的氢置换出来。正确。C.甲中Zn作负极,发生氧化反应而质量减少,Cu作正极,电极本身不参加反应,所以铜片质量不变;乙中Zn由于活动性比H强,所以可以和盐酸发生置换反应产生氢气,因此锌片质量减少。错误。D.在两烧杯中硫酸不断被消耗,c(H+)减小,因此溶液的pH均增大。正确。②由于在甲烧杯中形成了原电池,可以加快化学反应速率。所以在相同时间内,两烧杯中产生气泡的速度:甲>乙。③在甲烧杯中形成了原电池,负极的电极式为Zn - 2e- = Zn2+。④n(H2)= 1.12L÷22.4L/mol=0.05mol.所以消耗的H+的物质的量为0.1mol.n(H+)(总)=0.1mol+0.1 mol/L×1L=0.2mol。所以原溶液中c(H+)=0.2mol÷0.1L=2mol/L。c(H2SO4)="1/2" c(H+)= 1mol/L。(3)通入氢气的电极为负极;通入氧气的电极为正极。因此氢气应通入电极b;氧气应通入电极a.电子从负极b流出,流入到正极b电极。
考点:考查原电池形成的条件、原电池反应对化学反应速率、溶液的酸碱性的比较、电极反应和电极的判断等知识。

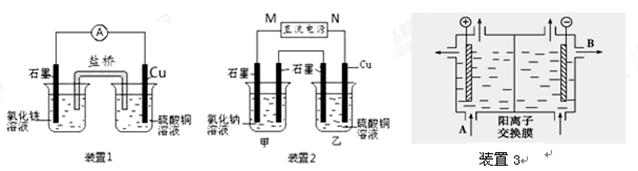
某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| ① | Mg 、Al | 稀盐酸 | 偏向Al |
| ② | Al、Cu | 稀盐酸 | 偏向Cu |
| ③ | Al、石墨 | 稀盐酸 | 偏向石墨 |
| ④ | Mg、Al | NaOH溶液 | 偏向Mg |
| ⑤ | Al、Zn | 浓硝酸 | 偏向Al |
根据上表中的实验现象完成下列问题:
(1)实验①、②中Al所作的电极是否相同?
答:____________________________________________
(2)写出实验③中的电极名称、电极反应式和电池总反应方程式。铝为( )______________________________
石墨为( )__________________________
电池总反应:__________________________
(3)实验④中的铝作________极。
(4)实验⑤中铝作________极。
(1)将等物质的量的KI和CuCl2溶于水,用惰性电极电解,该电解反应可分为________个阶段(表格不一定填满,若不够还可以自行添加)。
| 阶段 | 相当于电解什么溶液 | 离子方程式 |
| ① | | |
| ② | | |
| ③ | | |
| ④ | | |
| ⑤ | | |
(2)画出过程中溶液pH随时间变化的曲线(假定生成的Cl2全部逸出)。
 2Ni(OH)2
2Ni(OH)2
 Cu2O+H2↑
Cu2O+H2↑