题目内容
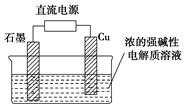
(15分)制烧碱所用盐水需两次精制。第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、Fe3+、SO42-等离子,过程如下:
Ⅰ.向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ.向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ.滤液用盐酸调节pH,获得一次精制盐水。
(1)过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20℃/g)如下表:
| CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
| 2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
②过程Ⅰ选用BaCl2而不选用CaCl2,运用表中数据解释原因____________________。
③除去Mg2+的离子方程式是_______________________________。
④检测Ca2+、Mg2+、Ba2+是否除尽时,只需检测_______(填离子符号)。
(2)第二次精制要除去微量的I-、IO3-、NH4+、Ca2+、Mg2+,流程示意如下:

①过程Ⅳ除去的离子是________________。
②盐水b中含有SO42-。Na2S2O3将IO3-还原为I2的离子方程式是________________。
③过程VI中,在电解槽的阴极区生成NaOH,结合化学平衡原理解释:___________。
(1)① 取少量过程II后的滤液于试管中,滴加几滴KSCN 溶液,若溶液不变红,说明Fe 3+已除尽;反之没除尽(2分)
③ 2Mg2++2CO32-+H2O=Mg2(OH)2CO3↓+CO2↑(3分)
④Ba2+(2分)
(2)① NH4+、I-(2分)
② 5S2O32-+8IO3-+2OH-=4I2+10SO42-+H2O(3分)
③阴极H+放电,促进水的电离, OH-浓度增大,Na+向阴极区移动,生成NaOH(2分)
解析试题分析:(1)①检测Fe3+是否除尽用KSCN溶液。②根据表中数据可以看出:BaSO4的溶解度比CaSO4的小,可将SO42-沉淀更完全。③除去Mg2+的离子方程式:2Mg2++2CO32-+H2O=Mg2(OH)2CO3↓+CO2↑。④根据表格中部分沉淀及其溶解度,可以看出BaCO3溶解度最大,则检测Ca2+、Mg2+、Ba2+是否除尽时,只需检验Ba2+,即可。
(2)①过程Ⅳ加入NaClO,是强碱弱酸盐,同时NaClO具有强氧化性,故能氧化NH4+、I-分别生成氮气和碘,即除去的离子为NH4+、I-。
②Na2S2O3将IO3-还原为I2,生成硫酸根离子、碘单质等,根据氧化还原反应方程式和离子方程式的配平方法,离子方程式为:5S2O32-+8IO3-+2OH-=4I2+10SO42-+H2O。
③过程VI中,电解NaCl溶液,在电解槽的阴极区电极反应为:2H++2e-=H2↑,即,阴极H+放电,促进水的电离,OH-浓度增大,Na+向阴极区移动,生成NaOH。
考点:考查常见离子的检验、氧化还原反应及电化学等知识。

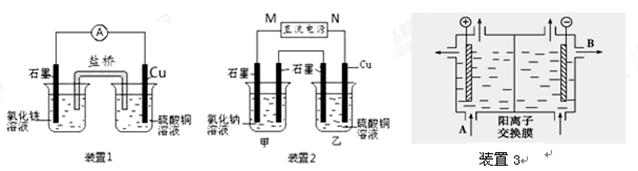
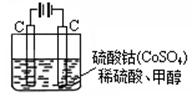
下图所示装置中,观察到电流计指针偏转,M棒变粗,N棒变细,由此判断下表中所列M、N、P物质,其中可以成立的是( )
| | M | N | P |
| A | 锌 | 铜 | 稀硫酸溶液 |
| B | 铜 | 铁 | 稀盐酸溶液 |
| C | 银 | 锌 | 硝酸银溶液 |
| D | 锌 | 铁 | 硝酸铁溶液 |
 2Ni(OH)2
2Ni(OH)2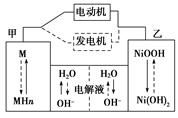
 Cu2O+H2↑
Cu2O+H2↑