题目内容
(10分) 如图所示装置: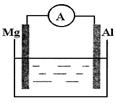
(1)若烧杯中溶液为稀硫酸,则观察到的现象为: 。
两极反应式为:正极 ;负极 。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为 ,
总反应方程为 。
(1)镁逐渐溶解,铝极上有气泡冒出,电流表指针发生偏转;
正极:2H++2e—=H2↑ ; 负极:
(2)Al;2Al+2NaOH+2H2O=2NaAlO2+3H2↑
解析试题分析:(1)若烧杯中溶液为稀硫酸,则构成原电池,Mg活动性比Al强,作原电池的负极,电极反应式是:Mg-2e—=Mg2+;Al活动性弱,作正极,正极反应式是2H++2e—=H2↑。观察到的现象为:镁逐渐溶解,铝极上有气泡冒出,电流表指针发生偏转;(2)若烧杯中溶液为氢氧化钠溶液,则Mg作正极,Al作负极,总反应方程为2Al+2NaOH+2H2O=2NaAlO2+3H2↑。
考点:考查原电池的正负极与金属活动性、电解质溶液的关系、电极反应式的书写的知识

练习册系列答案
相关题目
在化学能与电能的转化过程中,下列叙述正确的是 ( )
| A.电解饱和食盐水时,阳极得到Cl2 和NaOH(aq) |
| B.教材所示的铜-锌原电池在工作时,Zn2+ 向铜片附近迁移 |
| C.电镀时,电镀槽里的负极材料发生氧化反应 |
| D.原电池与电解池连接后,电子从原电池负极流向电解池阳极 |
如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是 ( )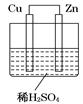
| 实验后的记录: ①Cu为负极,Zn为正极 ②Cu极上有气泡产生,发生还原反应 ③ 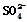 向Cu极移动 向Cu极移动④若有0.5mol电子流经导线,则可产生0.25mol气体 ⑤电子的流向是:Cu―→Zn ⑥正极反应式:Cu—2e-===Cu2+,发生氧化反应 |

 Fe2++H2↑。
Fe2++H2↑。


