题目内容
常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:
2Fe2++H2O2+2H+=2Fe3++2H2O,2Fe3++H2O2=2Fe2++O2↑+H+,下列说法正确的是( )
A.H2O2的氧化氢比Fe3+强,其还原性比Fe2+弱
B.在H2O2分解过程中,溶液的pH逐渐下降
C.在H2O2分解过程中, Fe2+和Fe3+的总量保持不变
D.H2O2生产过程要严格避免混入Fe2+
【答案】CD
【解析】由氧化还原反应的强弱律可知,氧化性是氧化剂大于氧化产物,还原性是还原剂大于还原产物,由方程一可知,氧化剂H2O2氧化性比氧化产物Fe3+强,由方程二可知,还原剂H2O2还原性比,原产物为Fe2+强,所以A错误;方程一和方程二相加,即H2O2分解生成H2O和O2,H2O2呈弱酸性,所以随着反应进行,pH升高,B错误;H2O2分解Fe3+或Fe2+作催化剂,所以总量不变,C正确;因为Fe2+可导致H2O2分解,所以H2O2生产过程要避免混入Fe2+,D正确
【考点分析】氧化性和还原性强弱的比较考查。

练习册系列答案
相关题目
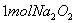 固体中含离子总数为
固体中含离子总数为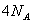
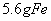 与足量稀
与足量稀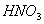 反应,转移
反应,转移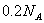 个电子
个电子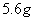 乙烯与丁烯的混合物中含有的氢原子的数目为
乙烯与丁烯的混合物中含有的氢原子的数目为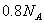
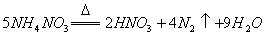 反应中,生成
反应中,生成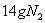 时,转移的电子数目为
时,转移的电子数目为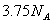
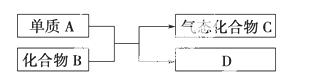
 ______________________。
______________________。 :
: 产生,产生大量白烟的原因是____________________________________________________________。
产生,产生大量白烟的原因是____________________________________________________________。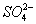 有一部分是氧化产物
有一部分是氧化产物 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2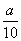 g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用0.02000mol·L-1
g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用0.02000mol·L-1 2Z(g)一定达到化学平衡状态 ( )
2Z(g)一定达到化学平衡状态 ( )