题目内容
从矿物学资料查得,一定条件下自然界存在如下反应:
14CuSO4+5FeS2 +12H2O====7Cu2S+5FeSO4 +12H2SO4。下列说法正确的是 ( )
A. Cu2S既是氧化产物又是还原产物
B. 5 mol FeS2发生反应,有12 mol电子转移
C. 产物中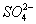 有一部分是氧化产物
有一部分是氧化产物
D. FeS2只作还原剂
【答案】C
【解析】分析反应
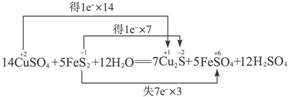
可知,FeS2中S的化合价降低生成Cu2S,升高生成FeSO4,故FeS2既是氧化剂又是还原剂,D错误;CuSO4中Cu的化合价降低生成Cu2S,FeS2中S的化合价也降低生成Cu2S,故Cu2S只是还原产物,非氧化产物,A错误;5 mol FeS2发生反应,有21 mol 电子转移,B错误;产物中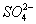 有一部分是氧化产物,另一部分由CuSO4提供,C正确。
有一部分是氧化产物,另一部分由CuSO4提供,C正确。
【考点分析】考查学生对氧化还原相关概念的辨析和计算能力

练习册系列答案
相关题目
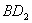 分子的电子式为__________,
分子的电子式为__________,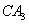 分子的空间立体构型为__________。
分子的空间立体构型为__________。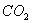 和液态
和液态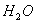 ,放出Q kJ热量,则表示H的燃烧热的热化学方程式为____________________。某燃料电池用H作燃料,KOH为电解液,该电池的负极电极反应式为:________________________________________。
,放出Q kJ热量,则表示H的燃烧热的热化学方程式为____________________。某燃料电池用H作燃料,KOH为电解液,该电池的负极电极反应式为:________________________________________。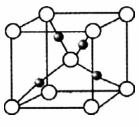
 最外层电子数之和为10。D为无色气体且不能燃烧,G为黄绿色单质气体,J、M为金属,
最外层电子数之和为10。D为无色气体且不能燃烧,G为黄绿色单质气体,J、M为金属, I有漂白作用,反应①常用于制作印刷电路板。请回答
I有漂白作用,反应①常用于制作印刷电路板。请回答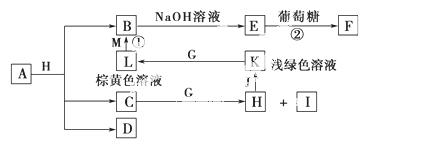
 bY(g)+cZ(g)达到平衡后,把容器体积压缩到原来的一半且达到新平衡时,X的物质的量浓度由0.1 mol·L-1增大到0.19 mol·L-1,下列判断正确的是( )
bY(g)+cZ(g)达到平衡后,把容器体积压缩到原来的一半且达到新平衡时,X的物质的量浓度由0.1 mol·L-1增大到0.19 mol·L-1,下列判断正确的是( )