题目内容
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
(1)冶炼铜的反应为8CuFeS2+21O2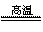 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号)。
(2)上述冶炼过程中产生大量SO2。下列处理方案合理的是 (填代号)。
a.高空排放
b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO3
d.用浓硫酸吸收
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:
S2O82-+2I-=2SO42-+I2
通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应的催化过程。 、 (不必配平)。
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、AI2O3)可制备Fe2O3。方法为
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得。
据以上信息回答下列问题:
a.除去Al3+的离子方程式是 。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为 。证明炉渣中含有的实验现象为
。
答案:
(1)Cu、O
(2)b、c
(3)2Fe3++2 =2Fe2++I2
=2Fe2++I2  +2Fe2+=2SO42-+2Fe3+(离子方程式不配平不扣分)
+2Fe2+=2SO42-+2Fe3+(离子方程式不配平不扣分)
(4)a:稀硫酸、KMnO4溶液
b:稀硫酸浸取炉渣所得溶液能使KMnO4溶液褪色
【解析】:(1)若CuFeS2中Fe的化合价为+2,则Cu化合价为+2,S化合价为-2,分析化学方程式两边元素化合价的变化可知,化合价降低的元素被还原,有Cu和O元素。关于SO2的吸收问题,一是不能高空排放,因为这样做,没有从根本上解决污染问题;二是不能用浓硫酸吸收,因SO2难溶于浓硫酸。只有变废为宝,才能符合“绿色化学”的概念,答案选b、c.
(2)此题要从催化剂的本质出发,作为催化剂的物质要参与有关反应,但后来的反应必须又生成了催化剂。本题要求写出表示Fe3+作催化剂的反应,因此,首先Fe3+要参与反应,即有反应2Fe3++2I-=2Fe2+ +I2,生成的Fe2+又被 -氧化生成了Fe3+。此题若要求写出Fe2+对上述反应的作催化剂的话,就应写成如下方程式:
-氧化生成了Fe3+。此题若要求写出Fe2+对上述反应的作催化剂的话,就应写成如下方程式: +Fe2+=2
+Fe2+=2 +2Fe3+,2Fe3++2I-=2Fe2+ +I2,虽是二个相同反应方程式,由于二者的前后顺序的颠倒,却产生了本质的区别
+2Fe3+,2Fe3++2I-=2Fe2+ +I2,虽是二个相同反应方程式,由于二者的前后顺序的颠倒,却产生了本质的区别
(3)此题考查是混合物的分离与提纯及常见离子的鉴别。因Al2O3溶于酸后生成了Al3+,Al3+又能与过量NaOH的反应生成可溶性的钠盐(NaAlO2),然后将溶液中的难溶物Fe(OH)3沉淀过滤出来,将沉淀洗涤、干燥、煅烧得Fe2O3。故除去Al3+的离子方程式是Al3++4 =
= +2H2O。要证明炉渣中含有FeO的方法,最好利用Fe2+的还原性,先将混合物溶于过量的稀硫酸中(FeO→Fe2+),然后滴入KMn04溶液,观察其溶液是否褪色。注意所用酸不能是硝酸或盐酸,因硝酸会将Fe2+氧化成Fe3+;盐酸会还原KMnO4溶液而使之褪色,干扰了Fe2+的检验
+2H2O。要证明炉渣中含有FeO的方法,最好利用Fe2+的还原性,先将混合物溶于过量的稀硫酸中(FeO→Fe2+),然后滴入KMn04溶液,观察其溶液是否褪色。注意所用酸不能是硝酸或盐酸,因硝酸会将Fe2+氧化成Fe3+;盐酸会还原KMnO4溶液而使之褪色,干扰了Fe2+的检验
【考点分析】氧化还原反应综合应用

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案