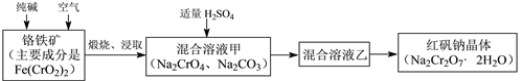
题目内容
【题目】CO2作为资源再利用是重要的研究课题,工业上用CO2产生燃料甲醇的化学方程式:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)。回答下列问题:
CH3OH(g)+H2O(g)。回答下列问题:
(1)由CO2制备甲醇过程涉及反应如下:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H1
CH3OH(g)+H2O(g)△H1
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3
CH3OH(g) △H3
已知反应Ⅰ、反应Ⅱ、反应Ⅲ的化学平衡常数分别为K1、K2、K3,则K1_______(用K2、K3表示)
(2)一定条件下,在3L恒容密闭容器中充入一定量的H2和CO2,研究反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1,实验测得反应物在不同起始投入量下,反应体系中CO2的平衡转化率与温度的关系曲线如下图所示。
CH3OH(g)+H2O(g) △H1,实验测得反应物在不同起始投入量下,反应体系中CO2的平衡转化率与温度的关系曲线如下图所示。
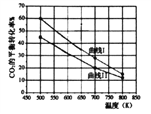
①H2和CO2的起始的投入量以A和B两种方式投入:
A:n(H2)=3mol,n(CO2)=1.5mol,
B:n(H2)=3mol,n(CO2)=2mol
曲线Ⅱ代表______(填“A”或“B”)投入方式反应的△H1________0(填“﹥”或“<”)
②在温度为500K的条件下,充入3molH2和1.5molCO2,该反应5min时达到平衡,此温度下的平衡常数为_______(mol·L-1)-2
③500K时,若在此容器中开始充入0.3molH2和0.9molCO2、0.6molCH3OH、0.6molH2O,则反应向______方向进行(“正反应”或“逆反应”)
【答案】 K2·K3 B < 450 正反应
【解析】试题分析:本题考查化学平衡常数的计算和应用,化学平衡图像的分析。
(1)根据化学平衡常数的定义,K1=[c(CH3OH)·c(H2O)]/[c(CO2)·c3(H2)],K2=[c(CO)·c(H2O)]/[c(CO2)·c(H2)],K3=c(CH3OH)/[c(CO)·c2(H2)],则K1=K2·K3。
(2)①B与A对比,增大CO2物质的量,平衡向正反应方向移动,B中H2的平衡转化率大于A中,B中CO2的平衡转化率小于A中,相同温度下曲线II中CO2的平衡转化率小于曲线I,则曲线II代表B投入方式。由图像知升高温度CO2的平衡转化率减小,升高温度平衡向逆反应方向移动,逆反应为吸热反应,ΔH1![]() 0。
0。
②由图像知,在温度为500K的条件下,充入3molH2和1.5molCO2,达到平衡时CO2的转化率为60%,用三段式
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
c(起始)(mol/L)0.5 1 0 0
c(转化)(mol/L)0.5![]() 0.6=0.3 0.9 0.3 0.3
0.6=0.3 0.9 0.3 0.3
c(平衡)(mol/L)0.2 0.1 0.3 0.3
此温度下的平衡常数为[0.3mol/L![]() 0.3mol/L]/[0.2mol/L
0.3mol/L]/[0.2mol/L![]() (0.1mol/L)3]=450(mol·L-1)-2。
(0.1mol/L)3]=450(mol·L-1)-2。
③开始H2、CO2、CH3OH、H2O的物质的量浓度依次为0.1mol/L、0.3mol/L、0.2mol/L、0.2mol/L,此时浓度商为[0.2mol/L![]() 0.2mol/L]/[0.3mol/L
0.2mol/L]/[0.3mol/L![]() (0.1mol/L)3]=133.3(mol·L-1)-2
(0.1mol/L)3]=133.3(mol·L-1)-2![]() 450(mol·L-1)-2,则反应向正反应方向进行。
450(mol·L-1)-2,则反应向正反应方向进行。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案