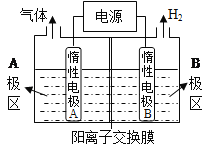
��Ŀ����
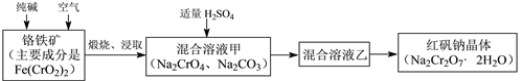
����Ŀ���ظ������׳ƺ췯��(Na2Cr2O7��2H2O)������Ҫ�Ļ�����Ʒ��ǿ����������ҵ�Ʊ��췯�Ƶ��������£�
��1����Ԫ�������ڱ��е�λ��___________���Ƶ�ԭ�ӽṹʾ��ͼ_____________��
��2����ѧ�Ͽɽ�ijЩ��д�����������ʽ����Na2SiO3��д��Na2O��SiO2����Fe(CrO2)2��д��__________��
��3�����ո�����ʱ����ʯ�����ܵ�Fe(CrO2)2���ɿ�����ˮ��Na2CrO4����Ӧ��ѧ����ʽ���£�4Fe(CrO2)2+ 8Na2CO3+7O2 = 2Fe2O3+8Na2CrO4+8CO2 ��Ϊ�˼ӿ�÷�Ӧ�ķ�Ӧ���ʣ��ɲ�ȡ�Ĵ�ʩ��________________����дһ�ּ��ɣ�
��4����֪CrO42���ڲ�ͬ��������Һ���в�ͬ�ķ�Ӧ���磺2CrO42��+2H+= Cr2O72��+H2O��3CrO42��+4H+= Cr3O102��+2H2O
���������Һ���м����������������ԭ����__________________________________��
�ڻ����Һ�������ʵĻ�ѧʽ��______________________________________________��
��5����ƽ������Һ��ԭ���з��������ӷ�Ӧ��________________��
Cr2O72��+S2��+H2O��Cr(OH)3+S2O32��+OH��
���𰸡� �������ڵ�VIII�� 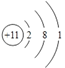 FeO��Cr2O3 �����ʯ�������¶� �������ܳ���Na2CO3������������������Na2Cr3O10�ȸ����� Na2Cr2O7��Na2SO4 4 6 19 8 3 14
FeO��Cr2O3 �����ʯ�������¶� �������ܳ���Na2CO3������������������Na2Cr3O10�ȸ����� Na2Cr2O7��Na2SO4 4 6 19 8 3 14
����������������봿�ͨ��������գ�����ȡ��õ�Na2CrO4��Na2CO3�������������ᣬ�õ������Һ�Һ���Na2Cr2O7��Na2SO4��Ȼ��ᾧ�ɵõ�Na2Cr2O7���壬��
��1����Ԫ�ص�ԭ��������26�������ڱ��е�λ���ǵ������ڵ�VIII�壬�Ƶ�ԭ�ӽṹʾ��ͼΪ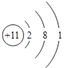 ����2��Fe(CrO2)2����Ԫ�ػ��ϼ���+2�ۣ�������ΪFeO����Ԫ�ػ��ϼ�+3�ۣ�������ΪCr2O3������Fe(CrO2)2д����������ʽΪFeO��Cr2O3����3������Ӧ��Ӵ�������Լӿ췴Ӧ���ʣ������¶ȿ��Դ��ӿ췴Ӧ���ʣ�����Ϊ�˼ӿ�÷�Ӧ�ķ�Ӧ���ʣ��ɲ�ȡ�Ĵ�ʩ�Ƿ����ʯ�������¶ȣ���4���������������Գ���̼���ƣ������ᷢ����Ӧ3CrO42��+4H+=Cr3O102��+2H2O��������Na2Cr3O10�ȸ�������Ա������������������ڷ����˷�Ӧ2CrO42��+2H+= Cr2O72��+H2O��������Na2Cr2O7��Na2SO4�������������ʵĻ�ѧʽΪNa2Cr2O7��Na2SO4����5��CrO42����Cr3+��1mol CrO42����õ������ʵ���Ϊ1mol��2����6-3��=6mol��S2-��S2O32����2molS2-ʧȥ�������ʵ���Ϊ2mol��[2-��-2��]=8mol�����ݵ���ת���غ㣬��С������Ϊ24�����Է��������ӷ�ӦΪ4Cr2O72��+6S2��+19H2O��8Cr(OH)3��+3S2O32��+14OH����
����2��Fe(CrO2)2����Ԫ�ػ��ϼ���+2�ۣ�������ΪFeO����Ԫ�ػ��ϼ�+3�ۣ�������ΪCr2O3������Fe(CrO2)2д����������ʽΪFeO��Cr2O3����3������Ӧ��Ӵ�������Լӿ췴Ӧ���ʣ������¶ȿ��Դ��ӿ췴Ӧ���ʣ�����Ϊ�˼ӿ�÷�Ӧ�ķ�Ӧ���ʣ��ɲ�ȡ�Ĵ�ʩ�Ƿ����ʯ�������¶ȣ���4���������������Գ���̼���ƣ������ᷢ����Ӧ3CrO42��+4H+=Cr3O102��+2H2O��������Na2Cr3O10�ȸ�������Ա������������������ڷ����˷�Ӧ2CrO42��+2H+= Cr2O72��+H2O��������Na2Cr2O7��Na2SO4�������������ʵĻ�ѧʽΪNa2Cr2O7��Na2SO4����5��CrO42����Cr3+��1mol CrO42����õ������ʵ���Ϊ1mol��2����6-3��=6mol��S2-��S2O32����2molS2-ʧȥ�������ʵ���Ϊ2mol��[2-��-2��]=8mol�����ݵ���ת���غ㣬��С������Ϊ24�����Է��������ӷ�ӦΪ4Cr2O72��+6S2��+19H2O��8Cr(OH)3��+3S2O32��+14OH����